Conceptos de oxidación y reducción – Química 1
Tenemos que mencionar que el método de balanceo por oxido-reducción, tiene su fundamento en conceptos fundamentales en la química, los cuales son:
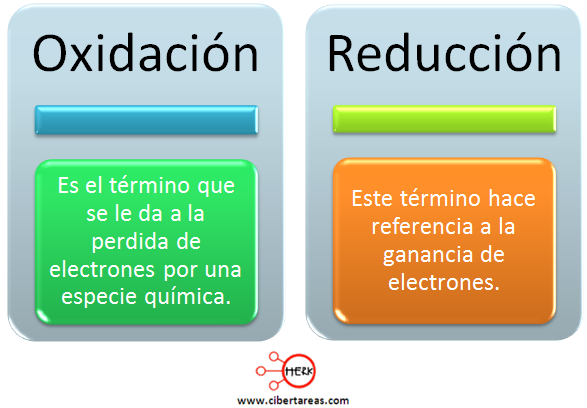
Para saber su en una reacción química un elemento gana o pierde electrones se aplica el concepto de número de oxidación, el cual es:
Vamos a considerar la siguiente ecuación química la cual se realiza para este ejemplo entre el hierro metálico y una solución de ácido clorhídrico, la ecuación es la siguiente:
Al momento de determinar los números de oxidación tenemos:
Se observa en la ecuación química:
– El hierro cambia su número de oxidación de 0 a +3, esto se debe a que pierde 3 electrones.
– El hidrogeno cambia su número de oxidación de +1 a 0, este se debe a que gana un electrón
Con estos datos, podemos concluir que el átomo de hierro se ha oxidado y el átomo de hierro se ha reducido.
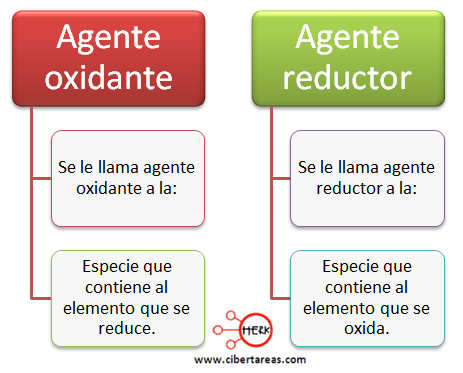
Existen otros dos conceptos que están relacionados con la oxidación y la reducción, estos son:
Tomando el ejemplo anterior, tenemos que:
– El hierro, es al mismo tiempo el elemento que se oxida y el agente reductor.
– El HCl, es el agente oxidante porque contiene al hidrogeno que es el elemento que se reduce.