Características de ácidos y bases en Temas Selectos de Química 2
Haciendo un poco de historia, se sabe desde la antigüedad que los ácidos y las bases adquirieron gran importancia debido a su enorme utilidad en:
-Curtido de las pieles
-Elaboración de untes
-Lavado de ropa, etc.
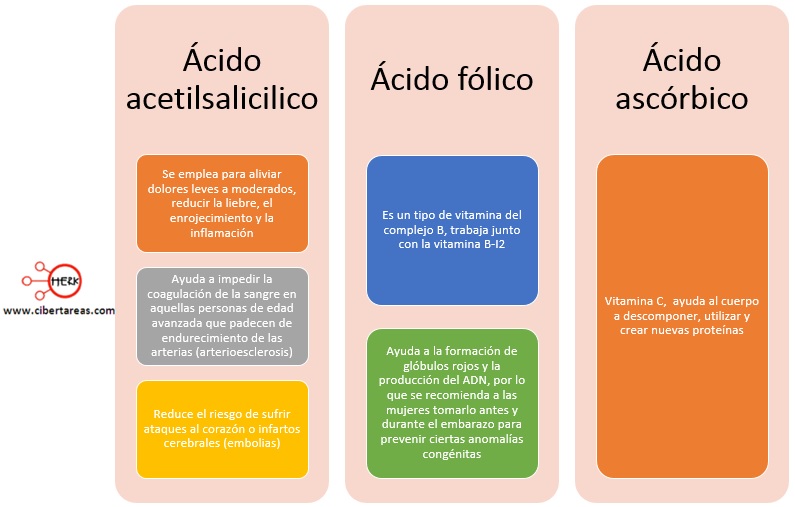
En la actualidad y gracias a los avances en el conocimiento sobre su naturaleza y comportamiento, los ácidos y las bases han encontrado nuevas y trascendentes aplicaciones, por ejemplo: