Concentración de iones hidronio y pH en Temas selectos de química 2
Debemos considerar que en el agua pura sucede un fenómeno muy interesante, ya que aunque no contenga ningún electrolito disuelto, ella misma se comporta como un electrolito muy débil y puede ionizarse
Dos moléculas de agua interacción entre si produciendo un ion hidronio y un ion hidroxilo por transferencia de un protón de una molécula de agua a la otra: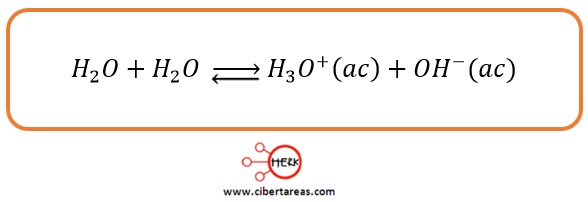
De lo cual se pude derivar una expresión para la constante de ionización:
Debemos considerar que en disoluciones muy diluidas la concentración del agua se considera constante, lo cual resulta fácil de comprender, debido a que los electrolitos que puede contener disueltos se encuentran presentes en tan pequeña cantidad que su concentración es despreciable y se tiene, prácticamente, agua pura
Por otro lado, se puede combinar la concentración del agua con la constante de ionización:
Con esto tenemos que la nueva constante K[H2O]2 recibe el nombre de constante de disociación del agua y se representa con la expresión Kw por lo que la expresión anterior se transforma en: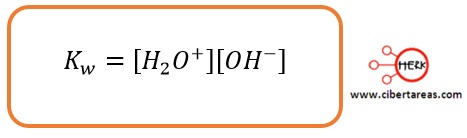
Experimentalmente se ha demostrado que el valor de Kw a 25 °C es igual a 1 x 10-14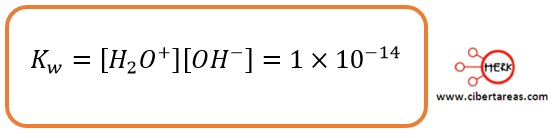
En el agua pura, las concentraciones de los iones hidrogeno e hidroxilo con iguales, por lo que: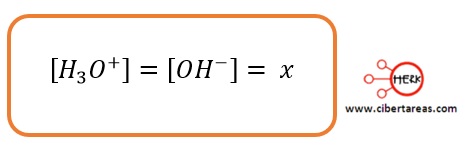
Si sustituimos lo anterior en la expresión para la constante de disociación del agua tendremos: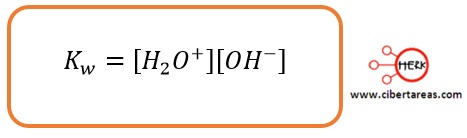
Tenemos que cuando la concentración de iones hidronio y de iones hidroxilo ene l agua es igual a 1 x 10-7 M se dice que el agua es neutra
Cuando al agua pura se le añade una cantidad de iones hidronio, la disolución se hace acida y el equilibrio se perturba, para poder volver a él, de acuerdo al principio de Le Chatelier, una pequeña cantidad de iones hidronio reacciona con iones hidroxilo provenientes de la autoionización para producir más moléculas de agua, lo que provoca una reducción de [OH–]
Al final, el producto de las concentraciones [H3O+][OH–] vuelve a establecerse en 1 x 10-14 M pero la concentración de iones hidronio es más elevada que la de iones hidroxilo
Algo similar sucede si se añade iones hidroxilo al agua pura, en este caso la disolución se vuelve básica
Como consecuencia, algunos iones hidroxilo reaccionarán con iones hidronio para formar mayor cantidad de moléculas de agua y volver al equilibrio
Pero, en este caso, la concentración final de iones hidroxilo supera a la de iones hidronio
A manera de resumen, hay que considerar lo que sucede en cada uno de los tres casos: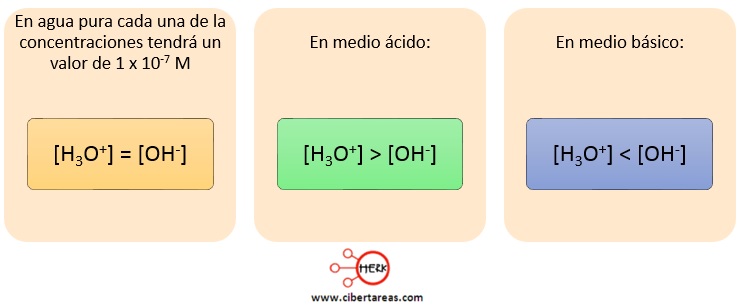
A pesar de la diferencia de concentraciones entre uno y otro ión, hay que recordar siempre que el producto de las concentraciones, en el equilibrio, tiene un valor de 1 x 10-14 M, lo cual puede aplicarse para conocer la concentración de uno, si se conoce la del otro
Ejemplo
-Consideremos que en una cierta disolución se ha calculado que [H3O+] = 4 x 10-7 M, es necesario calcular [OH-] y se necesita indicar si la disolución es neutra, ácida o básica
Solución
Se puede sustituir el dato que proporciona el problema para obtener:
Como en este caso [H3O+] > [OH–], la disolución es ácida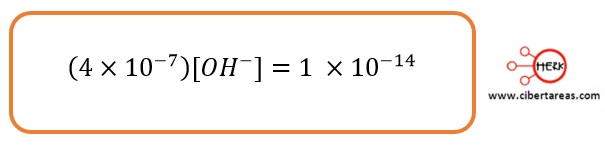
Para lo anterior es muy importante tomar en cuenta que las potencias negativas se entienden, por decirlo de alguna manera, “al revés” de las positivas
Entonces tenemos que 10-8 es diez veces menor que 10-7, mientras que en potencias positivas, 108 es diez veces mayor que 107


