Las ecuaciones químicas y la ley de la conservación de la materia – Química 1
Debemos de saber que toda reacción química establece una relación cualitativa y cuantitativa, regulada por la ley de la conservación de la materia, esta ley nos dice que:
Debemos relacionar esta ley con la química, ya que las reacciones químicas no están alejadas de esté principio, entonces, podemos mencionar a manera de ejemplo que si tenemos cierto número de átomos de un elemento en el lado izquierdo de la ecuación, se deben tener el mismo número de átomos en el lado derecho.
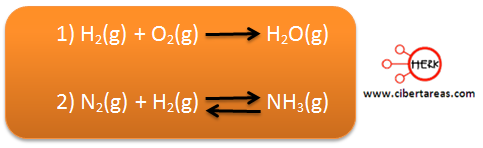
Entonces podemos decir que:
Estas ecuaciones no cumplen con la ley, ya que ninguna cuenta con el mismo número de átomos del lado derecho de los reactivos con relación a los productos, en la primera ecuación tenemos 2 átomos de oxígeno en el lado de los reactivos (derecho) y en el lado de los productos solo tenemos un átomo de oxigeno (izquierdo), sin embargo el hidrogeno si cumple con la ley.
En la segunda ecuación no existe coincidencia laguna entre los elementos que participan en la reacción.
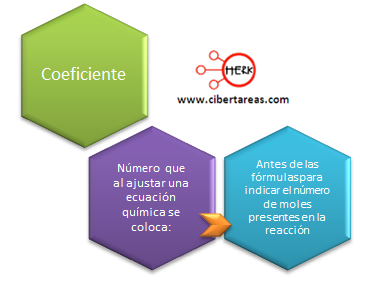
Para poder cumplir con la ley de la conservación de la materia, se tienen que balancear todos los átomos del lado izquierdo con los del lado derecho de las dos ecuaciones, para lograr esto, es necesario introducir coeficientes numéricos los cuales permiten igualar el número de átomos de cada elemento en ambos lados de la flecha.
Cuando se balancean las ecuaciones químicas, se dice que la reacción química se ajusta y cumple con la igualdad que debe haber en una ecuación.
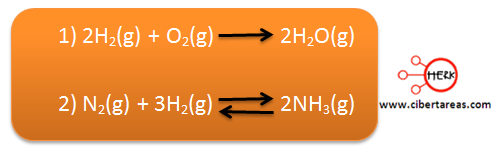
Entonces tenemos que las ecuaciones balanceadas quedarían:
Debemos considerar que el coeficiente afecta a todos los átomos que integran la formula.
Analicemos lo siguiente:
1) En la primera ecuación, el coeficiente 2 antes de H2, indica que hay cuatro átomos en total, ya que se multiplica el coeficiente 2 por el subíndice 2.
2) En la segunda ecuación, el coeficiente 2 antes NH3 (amoniaco) indica que en el lado izquierdo de la ecuación hay 2 átomos de nitrógeno y 6 átomos de hidrogeno.



miriam says:
muchas gracias lo entendí èrfectamente
Moon says:
Muchas gracias :”)