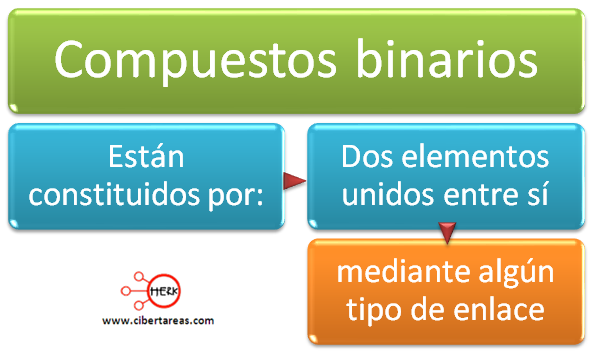
Compuestos binarios – Química 1
Estos compuestos están constituidos:
Los siguientes pasos son para poder escribir la fórmula:
1.- Es necesario anotar el símbolo del elemento positivo o catión, seguido del símbolo del elemento negativo o anión, esto se escribe con sus respectivos números de oxidación.
2.- Es necesario considerar que el número de oxidación del elemento positivo pasa como subíndice del negativo, prescindiendo del signo y viceversa.
2.1.- Cuando el número de oxidación es uno, este no se escribe en la formula, debido a que se sobreentiende.
2.2.- Si los números de oxidación son iguales en ambos iones, se neutralizan y no aparecen como subíndices en la formula.
2.3.- Cuando uno es múltiplo del otro, se dividen ambos entre el menor y los resultados correspondientes se fijan como subíndices definitivos.
Para nombrar al compuesto tenemos:
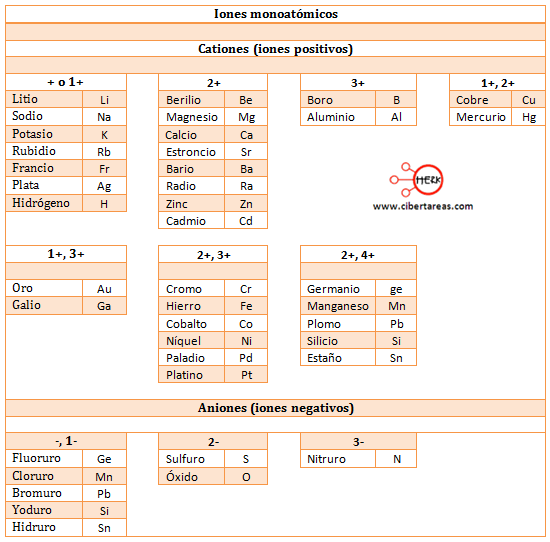
Es fundamental aprenderse una lista de aniones y cationes con los que se trabajara para poder escribir formulas químicas.
Lista de iones y cationes:
Nota: En la tabla anterior, resulta indistinto escribir el número de oxidación como +1 o 1+, incluso resulta indistinto en la parte de balanceo de ecuaciones.
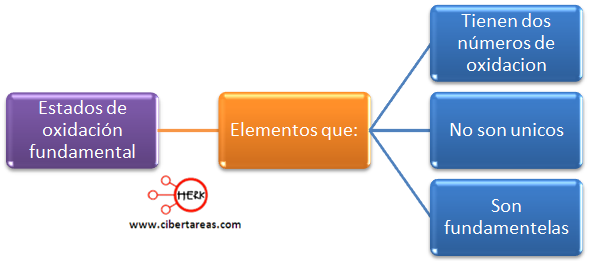
Es importante mencionar que existen elementos que:
Los ejemplos que a continuación se mencionan, siguen las reglas de nomenclatura del sistema Stock en compuestos binarios.
Primer ejemplo:
1.- Se elige un ion positivo u uno negativo, se procede a ordenarlos, primero el ion positivo y después el negativo.
2.- Se toma en primer lugar los que tienen un solo número de oxidación, para este ejemplo son:
3.- Notemos que los dos tiene un mismo numero de oxidación, por esta razón se neutralizan.
4.- Para nombrarlo debemos de seguir esta secuencia:
a) Se inicia con el anión:
-Bromuro
b) Después el nombre del catión:
-Potasio
c) Se precede con la preposición:
-“de”
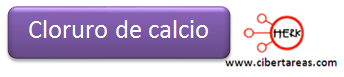
5.- Como resultado final tendremos:
Segundo ejemplo:
1.- Se toman dos iones, se ordenan de la siguiente manera:
El positivo del lado izquierdo
El negativo del lado derecho
2.- Se procede a cruzar los números de oxidación:
3.- La fórmula quedaría:
4.- EL nombre será:
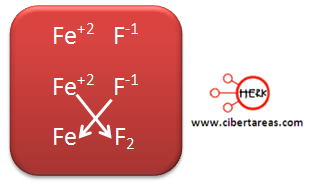
Tercer ejemplo:
1.- Se toman dos iones, se ordenan de la siguiente manera:
El positivo del lado izquierdo
El negativo del lado derecho
2.- Se cruzan los números de oxidación:
3.- En este caso el hierro tiene dos números de oxidación, y al momento de escribir el nombre de la formula, es necesario especificar el numero en romano al final y entre paréntesis
4.- La fórmula quedaría:
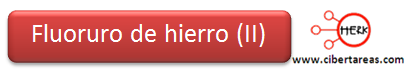
5.- El nombre será:
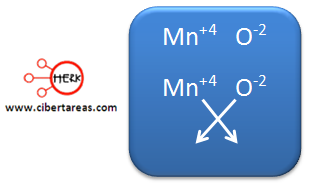
Cuarto ejemplo:
1.- Se toman dos iones, se ordenan de la siguiente manera:
El positivo del lado izquierdo
El negativo del lado derecho
2.- Se cruzan los números de oxidación:
3.- Para este caso, los números de oxidación son múltiplos, por esta razón lo que se puede hace es simplificarlos.
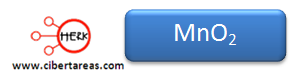
4.- La fórmula quedaría:
5.- El nombre será:










alejandra says:
muchas gracias!! me sirvio mucho. Queria preguntar, cuando un elemento tiene mas de un numero de oxidacion, como se cual tengo que elegir?
Enrique Aquino says:
Excelente informacion me ayudo mucho
angela says:
falta informacion