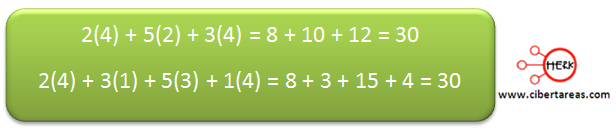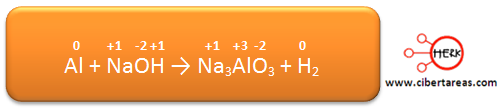Ejemplos del método de óxido-reducción – Química 1
Caso 1
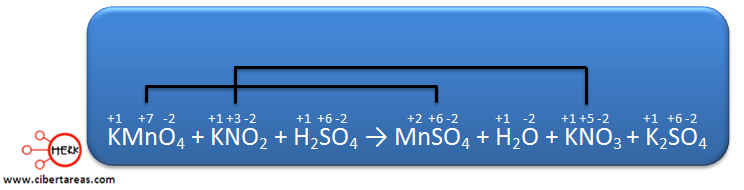
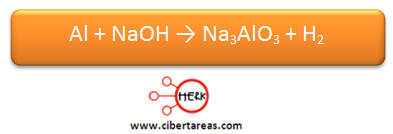
Se necesita realizar el balanceo de la siguiente ecuación:
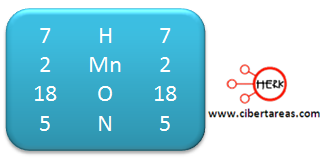
1.- Es necesario determinar los números de oxidación de todos los elementos, estos números son:
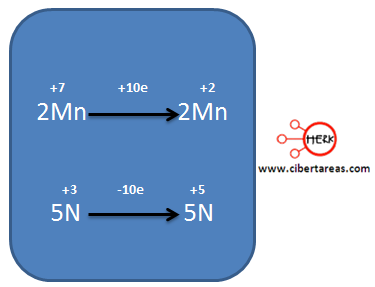
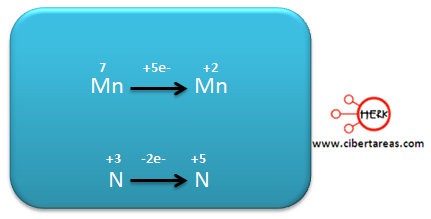
Analizando la ecuación podemos decir que los dos elementos cambian su estado de oxidación:
– El Mn pasa de +7 en los reactivos a +2 en los productos
– El N, pasa de +3 en los reactivos a +5 en los productos
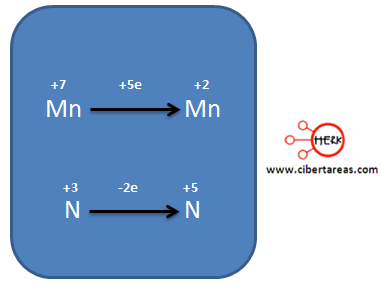
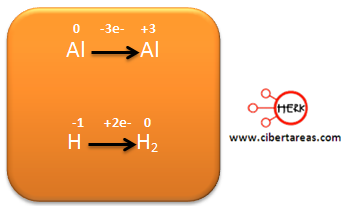
Al observar el siguiente esquema podemos analizar dos semirreacciones, una para el Mn y otra para el N, indicando los electrones que se ganan o pierden.
Al analizar el diagrama, tenemos que:
– El Mn pasa de +7 a +2, gano 5 electrones, es decir se reduce
– El N para de +3 a +5, perdió 2 electrones, es decir se oxida.
Existe otra forma para saber cuántos electrones se ganan o pierden, esta es:
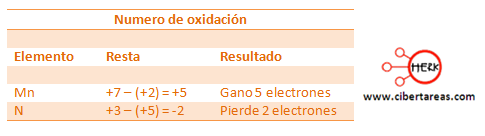
– Se resta el número de oxidación que se presenta en los reactivos con el número de oxidación que sé que presenta en el producto.
– Si el resultado es negativo, el elemento perdió electrones
– Si el resultado es positivo, el elemento gano electrones
Siguiendo el ejemplo y aplicando este método tenemos que:
2.- El siguiente paso es escribir des medias reacciones:
-La primera par el átomo que gana electrones (reducción)
-La segunda para el átomo que pierde electrones (Oxidación)
3.- El paso siguiente es balancear los átomos en cada una de las semirreacciones, es importante considerar que cualquier cambio en los coeficientes se refleja en los electrones que se han ganado o perdido.
Para este ejemplo, ya están balanceados
4.- El siguiente paso es balancear los electrones ganados y perdidos, para lograr esto:
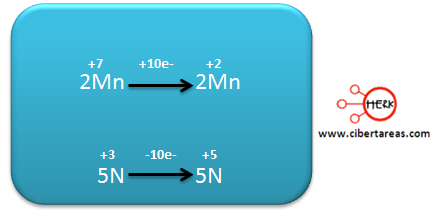
-Se multiplica en forma cruzada las dos semirreacciones
-Para nuestro caso se multiplica la primera por 2 y la segunda por 5
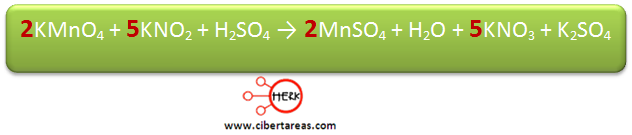
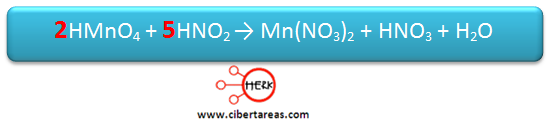
5.- A los productos de la reacción se les asignan los coeficientes encontrados, y posteriormente se ajustan sucesivamente la ecuación hasta que se finalice el balanceo
Se iguala el número de átomos de Mn, esto se hace colocando el coeficiente 2 en el KMnO4
Posteriormente se iguala el número de átomos de N, esto lo realizamos colocando el coeficiente 5 en KNO2
Observemos que los átomos de potasio se encuentran balanceados debido a:
-Existen 7 átomos en los reactivos y 7 en los productos.
Sin embargo los átomos del azufre no se encuentra balanceados ya que:
-Existen 1 átomo en los reactivos y 3 en los productos
Por esta razón se coloca un coeficiente 3 en H2SO4
Una vez que se coloca este coeficiente en el ácido sulfúrico, se tiene:
-Existen 6 átomos de hidrogeno en los reactivos y 2 en los productos.
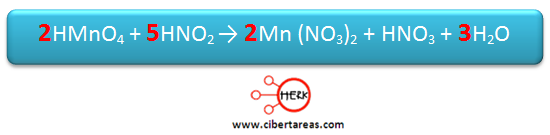
Al asignar un coeficiente 3 al H2O se ha terminado de balancear la ecuación
Antes de terminar, es necesario verificar si se ha balaceado correctamente, esto se hace contando los átomos de oxígeno en reactivos y determinar si son iguales en los productos:
Caso 2
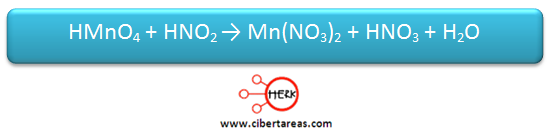
Es necesario realizar el balanceo por el método de óxido-reducción a la siguiente reacción:
1.- Se obtienen los números de oxidación para la reacción:
2.- Se determina cuáles son los elementos que cambian su número de oxidación cuando pasan de ser reactivos a productos:
3.- Se procede a balancear los átomos en cada semirreaccion, dado nuestro ejemplo no es necesario, ya que solo hay un átomo a cada lado en las dos semirreacciones.
4.- En este paso, se balancean los electrones perdidos con los ganados, para esto:
-Se realizan las multiplicaciones, la primera semirreaccion se multiplica por 2 y la segunda por 5
5.- Se le asigna a los productos de la reacción los coeficientes encontrados, mediante el tanteo, con esto se finaliza el balanceo:
5.1 Se le asignan los coeficientes
5.2 Por orden: metales, no metales, hidrógenos y oxígenos
5.3 Se verifica el correcto balanceo contando los átomos de oxigeno presentes en los reactivos para verificar que coincidan con los del producto
Caso 3
Es necesario balancear la siguiente ecuación por el método de óxido-reducción
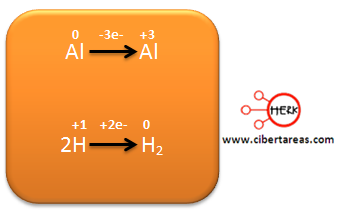
1.- Se obtienen los números de oxidación
2.- Se determinan los elementos que cambian su número de oxidación al pasar de reactivos a productos
3.- Se balancean los átomos en cada semirreacción, esto dependiendo del caso, para nuestro ejemplo es necesario hacerlo
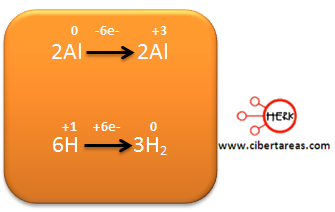
4.- Se balancean los electrones que se han perdido con los ganados, para realizar esto, se realiza una multiplicación:
– La primera semirreacción por 2 y la segunda semirreacción por 6
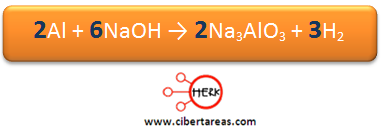
5.- Para finalizar el balanceo, se asignan estos coeficientes mediante el tanteo