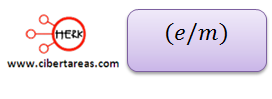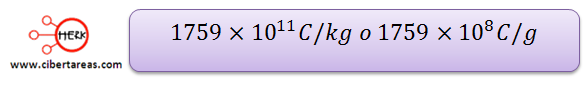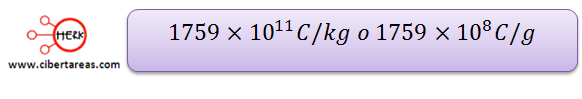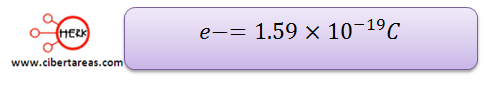El electrón y el modelo atómico de Thomson – Química 1
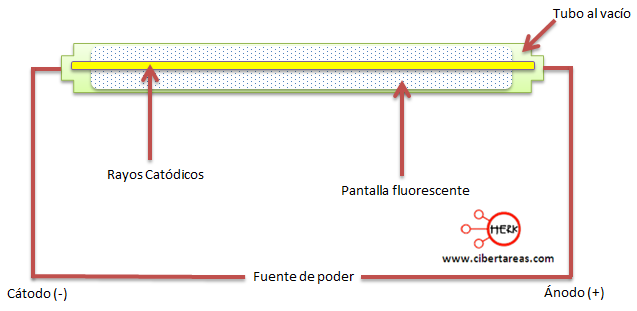
El realizador del experimento más importante para descubrir el electrón fue hecho por William Crookes, en sus experimentos, descubrió que después de transmitir una descargar de bajo voltaje a un gas, el cual estaba contenido en un tubo de vidrio, se obtenía una radiación luminosa y de color verde, el tubo estaba dotado de electrodos (tiras de metal cubiertas de sulfuro de zinc) y conectado a una bomba de vacío, con esta bomba se extrajo la mayor parte del aire del tubo.
El rayo viaja del electrodo negativo (cátodo), al electrodo positivo (ánodo), por lo que se les conoce como rayos catódicos.
Muchos experimentos con los rayos catodicos desmostraron que viajan en linea recta, si se les colocaba un oobjeto solido entre el catodo y el anodo, el rayo proyectaba una sombra en el resplandor del vidrio, a su vez se descubrio que el rayo tiene masa, ya que podian hacer girar un molinete.
Para poder determinar el carácter electrico de las partiulas de los rayos catodicos, Josepf J. Thompson, con sus experimentos pudo demostrar que los rayos catodicos de desviaban en un campo magnetico, ya que un objeto cargado electricamente era afectado por dos tipos de fuerza.
Estas fuerzas electromagneticas actuan soobre culquier objeto provisto de carga electrica, como los rayos catodicos tenian carga, entonces serian afectados por estas fuerzas, que actuan como la generada por un iman.
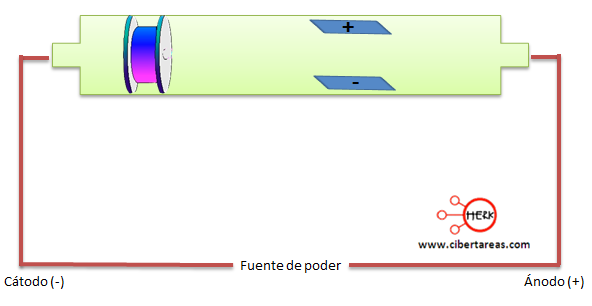
Joseph, diseño un dispositivo, modificando el tubo de rayos catodicos de Crookes, los rayos catodicos deberiand e atravezar una zona en la que se habia creado un campo electrico entre dos placas cargadas y un campo magnetico.
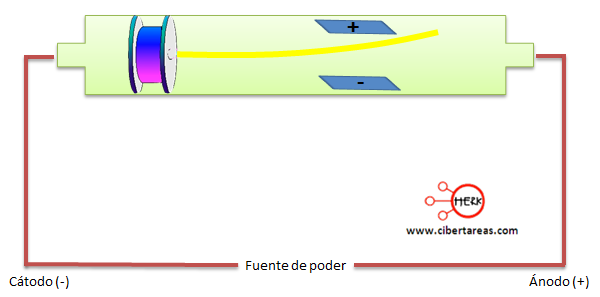
En el experimento, Thomson ajusto el voltaje de las palcas hasta que se compensaran los efectos del campo magnético, entonces si los rayos eran partículas, la trayectoria debía ser afectada por los imanes y por las grandes cargas eléctricas y el resultado fue que la placa positiva atraía el haz, y la placa negativa lo repelía
Thompson, concluyó que los rayos catódicos se componen de partículas con carga negativa a las que tiempo después George Stoney las llamo electrones.
Thomson logro descubrir una característica cuantitativa de los electrones, a esta característica la llamo carga específica, y cálculo la relación que guarda la masa del electrón respecto a su carga:
Tal que su cociente es:
Thomson determino aproximadamente el valor de la carga en:
Robert Andrew realizo la primera determinación precisa y directa de la carga del electrón. Su resultado fue:
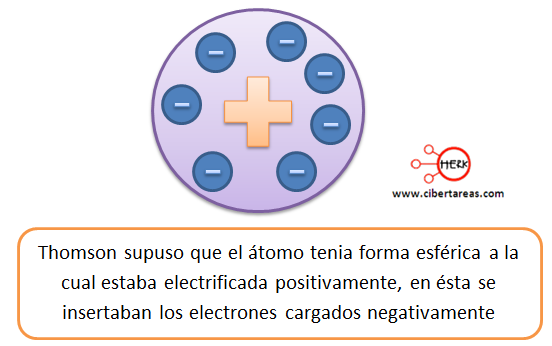
Cuando se descubrió el electrón, surgió el modelo del átomo en el que las cargas negativas se encontraban asociadas con las cargas positivas en una esfera uniforme.
Este modelo es conocido como “pastel con pasas” en donde los electrones representan las pasas.