Las reacciones de oxidación-reducción en la industria en Temas selectos de química 2
Hay que considerar que dentro del ámbito industrial existen varios ejemplos de procesos donde las reacciones redox son fundamentales, por ejemplo:
-Líneas generales para la fabricación del arrabio
-Material fundido que se obtiene mediante reducción del mineral de hierro
-Se utiliza como materia prima en la obtención de las aleaciones férricas fundamentales:
-Las fundiciones y los aceros
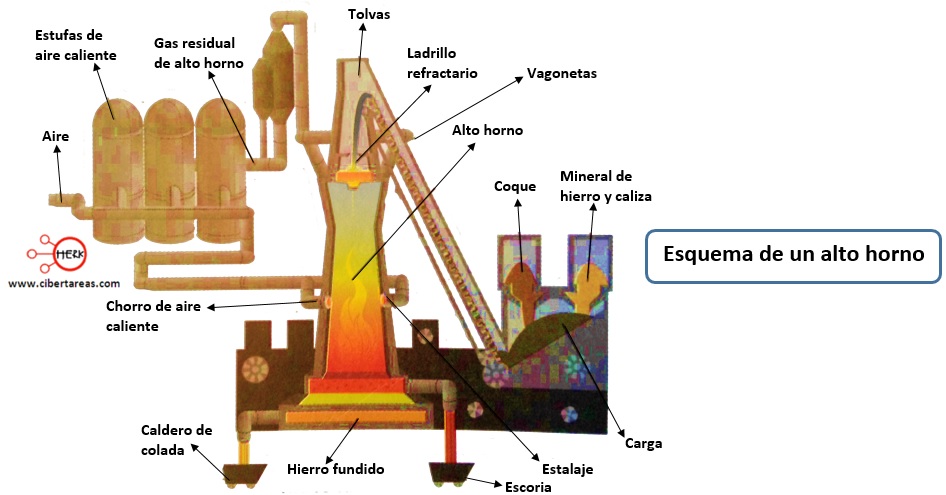
-De manera muy simplificada, la estructura de un alto horno consiste en dos conos truncados unidos por sus bases
-Como debe soportar temperaturas muy altas, el alto horno se forra internamente con ladrillo refractario
-En la operación, se carga al alto horno con:
-Mineral de hierro
-Principalmente, hematita (Fe2O3)
-Coque
-Residuo duro y poroso que resulta después de la destilación destructiva del carbón que servirá tomo combustible y como reductor
-Sustancia fundente
-Cuya composición variará en dependencia del tipo de ganga (mineral sin valor industrial que acompaña al mineral)
-Cuando el coque se quema libera monóxido de carbono, que al combinarse con los óxidos de hierro del mineral los reduce a hierro metálico
-Además del arrabio, que contiene aproximadamente 92% de hierro, 3 o 4% de carbono y pequeñas cantidades de silicio, manganeso, fósforo y azufre, se obtiene un material de desecho llamado escoria, que flota sobre el metal fundido y hace posible su separación
-El arrabio es sometido a varios procesos dentro de la planta siderúrgica para obtener acero como producto final
-El proceso redox que se da en un alto horno invierte el proceso natural y espontáneo que presenta el hierro, al igual que otros metales, que al encontrarse en la naturaleza tienden a combinarse con otros elementos químicos y el agua para formar minerales
-En el caso del hierro, los minerales a los que se hace referencia son:
La reducción del mineral para obtener hierro metálico es el propósito fundamental de los altos hornos
-Procesos electrolíticos para obtener aluminio
-Al analizar los procesos electrolíticos tenemos que son procesos redox que permiten obtener, con un alto grado de pureza, varios metales, entre ellos:
-Aluminio
-Sodio
-Cobre
-Al clasificarlos por su abundancia en la corteza terrestre:
-El aluminio ocupa el tercer lugar
-Sus compuestos agrupan, de manera aproximada:
-8% del total encontrado en la naturaleza
-Se le puede ubicar, en forma de tales compuestos, en la mayoría de las rocas, los vegetales y otros seres vivos
-Para obtener el aluminio se parte de la bauxita, agregado de varios minerales de aluminio e impurezas que se extrae de minas a cielo abierto
-Después de varios procesos, de la bauxita se obtiene la alúmina, que es en realidad óxido de aluminio (Al2O3) y que se emplea en el proceso Hall-Héroult para obtener, mediante electrólisis, el metal
-En el proceso Hall-Héroult la alúmina se disuelve en un baño de criolita (fluoruro alumínico sódico Na3AlF6) dentro de grandes contenedores o cubas electroliticas en los cuales se lleva a cabo la reducción
-Cuando se hace pasar una fuerte corriente eléctrica (aproximadamente, de 100 000 a 150 000 A) a través de la disolución de alúmina-criolita:
-Se obtiene en uno de los electrodos el aluminio con un alto grado de pureza, mientras que en el otro se produce oxigeno
-Finalmente, mediante un sifón se extrae el aluminio para su proceso final en la fabricación de diversos enseres domésticos e industriales
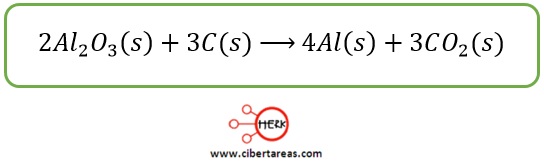
-La reacción esencial que se desarrolla en el proceso descrito es la siguiente:
-La ecuación representa una reacción redox en la que se logra la reducción del óxido de aluminio para obtener aluminio metálico




Fatima Perez says:
Es una excelente página con la información clara y precisa para los alumnos. He utilizado esa información para dar a conocer el tema de oxido reducción a los alumnos de tercero de secundaria. Muchas gracias.