Ley de las proporciones múltiples – Química 1
John Dalton, físico y químico británico, postulo en 1803 su ley de las proporciones múltiples, en la cual afirmaba:
La masa de un elemento se combina con la de otro, y estas masas guardan entre ellas una relación de números enteros sencillos.
Ejemplo:
En los experimentos de Dalton, descubrió que el carbono se combina con el oxígeno en dos proporciones:
Estas combinaciones dan origen a dos gases con propiedades diferentes a pesar de que para su formación se utilizan los mismos elementos.
El primer gas, es un gas toxico que tiene su origen por combustión incompleta, y el segundo gas es producto de la combustión completa o de la respiración. Estas leyes rigen la proporción en masa y volumen para formar compuestos.
En esta ley, Dalton propuso una teoría atómica para explicar estas leyes, en esta teoría, Dalton define al átomo como:
Los postulados básicos de la teoría de Dalton son:
La teoría de Dalton explica la diferencia que existe entre elementos (compuestos de un solo tipo de átomo) y las moléculas (combinación de dos o más tipos de átomo diferentes)
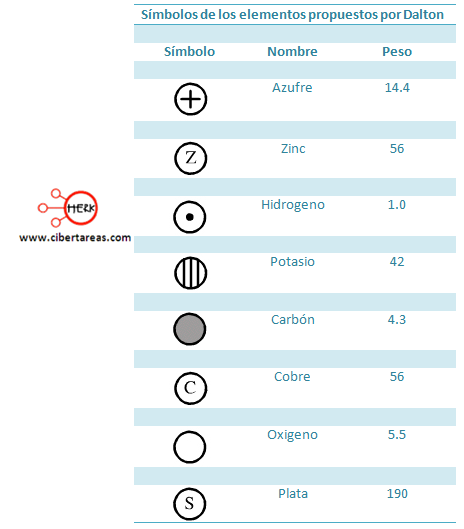
Otra de sus aportaciones es que fue el primero que elaboro una tabla de masas relativas de átomos y moléculas.
Dalton elaboro una serie de símbolos para representar a los elementos y las moléculas