Teoría de Brönsted-Lowry – Química 2
Johannes N.Brönsted, químico danés, y Thomas Lowry, químico británico, propusieron, cada uno de forma independiente, una teoría que mejora significativamente la propuesta de Arrhenius, ya que esta última se limitaba a las soluciones acuosas y se han encontrado reacciones ácido-base que se verifican en fase gaseosa o en solvente, distintos al agua, como el caso de:
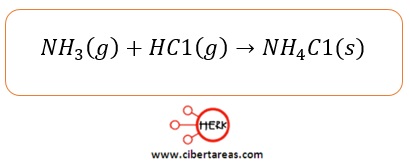
-Amoniaco
-Cloruro de hidrogeno
Estos reaccionan en fase gaseosa para formar una sal, el cloruro de amonio: