Modos de calcular la concentración de una disolución, Normalidad – Química 2
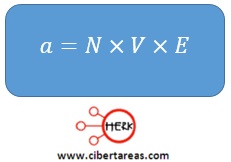
La normalidad (N) expresa la concentración de una solución y se define como:
Para calcular el peso equivalente (E) del soluto debe tomarse en cuanta el tipo de sustancia que se trata:
Ejemplo:
-Caso 1
Es necesario determinar el peso equivalente para las siguientes muestras:
-H2S (Ácido sulfúrico)
-Ca(OH)2 (Hidróxido de calcio)
-Al2(SO4)3 (Sulfato de aluminio)
Solución:
-Ácido sulfúrico
–Tiene una masa molar de 34 g/mol y como posee dos átomos de hidrogeno en su fórmula, su peso equivalente será: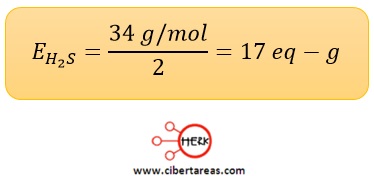
-Hidróxido de calcio
–Tiene una base molar aproximadamente igual a 74 g/mol y presenta dos grupos OH- en su fórmula, por lo que se obtiene: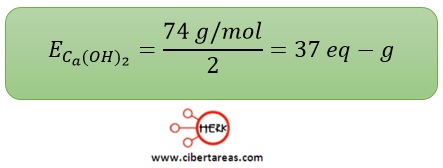
-Sulfato de aluminio
–Es una sal en cuya fórmula aparecen dos átomos de aluminio, cada uno de ellos tienen carga 3+, por lo que el total de cargas es de 6
-Se divide la masa molar 342 g/mol entre 6 para obtener el peso equivalente: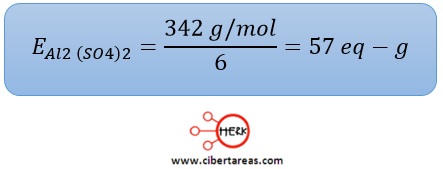
-Caso 2
Se necesita la preparación de una disolución con 2.5 g de nitrato de potasio (KNO3) con agua suficiente para preparar un volumen de 2.5 L
Es necesario determinar la normalidad e la solución
-Solución
-Datos:
a = 2.5 g
E = 101 eq – g
V = 2.5 L
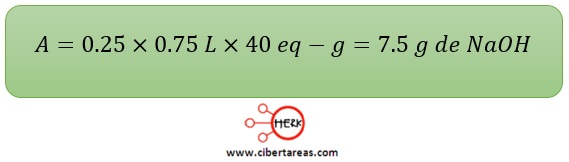
-Caso 3
Es necesario preparar 750 mL de solución 0.25 N de NaOH
Para esto, ¿Cuántos gramos de esta sustancia serán necesarios?
-Solución
Datos:
a = ?
E = 40 eq- g
V = 750 mL = 0.75 L
N = 0.25
Considerando la fórmula original:
Posteriormente al sustituir los valores se llega a la solución: