El ajuste de las reacciones de oxidación-reducción en Temas Selectos de Química 2
Es importante conocer cómo se ajustan las reacciones de óxido-reducción, para los casos más sencillos puede aplicarse el método de balanceo por inspección o, como acostumbra llamársele, de tanteo
Por ejemplo:
-Para balancear la ecuación que representa la reacción entre el azufre y el oxígeno
-No se requiere hacer ninguna operación en absoluto porque al examinarla encontramos que la cantidad de átomos en los reactivos es equivalente al de los átomos en productos: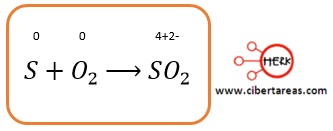
A manera de conclusión podemos afirmar que no se requiere hacer ninguna operación en absoluto porque al examinarla encontramos que la cantidad de átomos en los reactivos es equivalente al de los átomos en productos
Sin embargo para ajustar la ecuación siguiente se tiene cierta dificultad porque al equilibrar alguno, los demás se desajustan y aunque puede llegarse a la solución con esfuerzo y concentración, lo mejor es encontrar un método más adecuado
Método del cambio del número de oxidación
-Para ejemplificar este método se tiene la siguiente ecuación: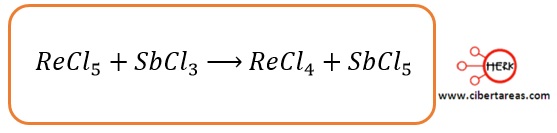
1.- Se determinan los números de oxidación de todos y cada uno de los elementos que intervienen en la reacción: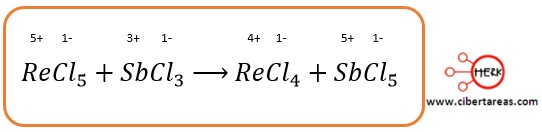
2.- Con esta información se pueden detectar los elementos que sufren una oxidación o una reducción:
3.- El renio se reduce (de 5+ a 4+, una disminución de 1) y el antimonio se oxida (de 3+ a 5+, un aumento de 2)
4.- Se colocan los coeficientes para que la disminución y el aumento total de los números de oxidación sean iguales
5.- Para lo anterior, se hace la siguiente consideración, el mínimo común múltiplo de 1 y 2, es 2, por lo que se anota un coeficiente 2 en el renio y un coeficiente 1 (que no se anota) en el antimonio: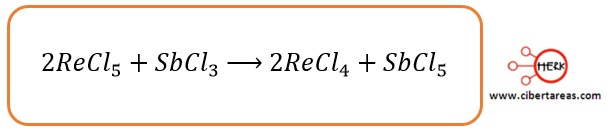
6.- El balanceo se concluye asignando los coeficientes necesarios para que se cumpla la ley de la conservación de la masa y todos y cada uno de los átomos estén en igual cantidad a ambos lados de la ecuación
En el ejemplo anterior no es necesario colocar otros coeficientes porque se tiene igual cantidad de átomos a ambos lados:
-2 de renio
-1 de antimonio
-13 átomos de cloro
En todos los casos es muy conveniente cerciorarse de que efectivamente haya igual cantidad de átomos de cada elemento, tanto a la derecha como a la izquierda
Este método de cambio en el número de oxidación puede aplicarse a las ecuaciones:
-Iónicas netas
-En las cuales se anotan exclusivamente los iones participantes en la reacción, más no los iones espectadores
Ejemplo (ecuaciones iónicas netas)
1.- En el ión clorato, el cloro tiene número de oxidación 5+ y pasa a 1-, se ha reducido debido a la ganancia de 6 electrones; el hierro, se oxidó de 2+ es 3+ y ganó un electrón
2.- El mínimo común múltiplo para 1 y 6 es 6, por lo que asignamos este número al hierro y el número 1 al cloro:
3.- Solo resta ajustar los átomos de oxígeno y los de hidrogeno
4.- Para equilibrar los átomos de oxígeno, que son 3 en los reactivos, se anota un 3 en el agua
5.- Ahora se tiene 6 átomos de hidrógeno en los productos y si se coloca un 6 en el ión hidrógeno la ecuación se balancea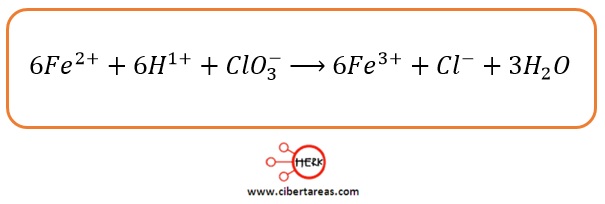
Al revisar cuidadosamente, elemento por elemento se puede verificar que la ecuación iónica está balanceada

