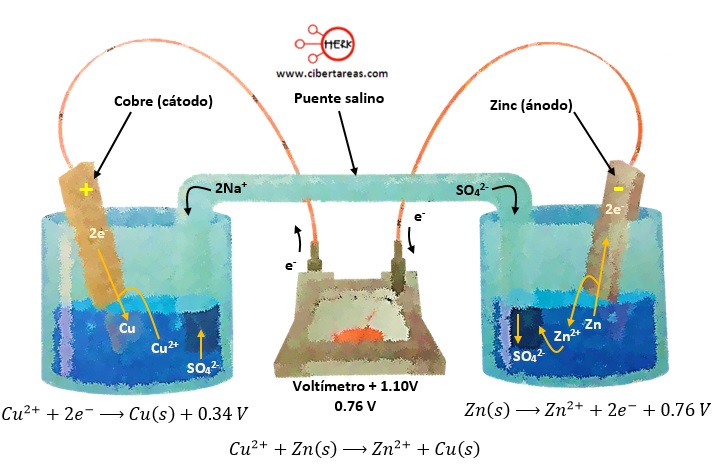
Celdas o pilas voltaicas en Temas selectos de química 2
Para ejemplificar el funcionamiento de una celda voltaica es necesario imaginar que:
-Se construyen dos medias celdas o semiceldas
-Que no son más que dos recipientes en los que se colocan electrolitos
-En una de ellas se coloca una solución capaz de proveer iones de Cu2+ y una tira de Cu metálico
-Que servirá corno electrodo, es decir, como un conductor para hacer contacto con una parte no metálica de un circuito
-En la otra semicelda se coloca una solución de iones Zn2+ y una tira de Zn metálico
-Que sería el otro electrodo
-En un tubo en forma de U se coloca una solución saturada de sulfato de sodio
-Na2SO4
-Se taponea con algodón o algún otro material poroso ambos extremos del tubo para evitar la salida del electrolito
– Este será el “puente salino”
-Para finalizar se instala un alambre que conecte ambos electrodos y un voltímetro que servirá para registrar la diferencia de potencial entre ambas semiceldas
Hay que considerar que en toda celda electroquímica, como es el caso de la celda voltaica:
-El nodo es el electrodo donde ocurre la oxidación
-En el cátodo se lleva cabo la reducción
Al analizar la imagen anterior, tenemos que la placa de Zn es el ánodo y la de Cu, el cátodo
Un método sencillo para recordar esta relación consiste en tener presente que: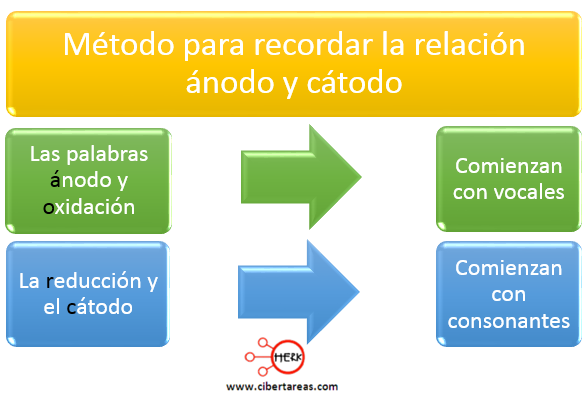
Por convención, al ánodo se le otorga el signo negativo y un signo positivo al cátodo, lo anterior se entiende con facilidad ya que si tomamos en cuenta que la oxidación (que ocurre en el ánodo), produce electrones y por ello adquiere carga negativa, por otro lado, al cátodo se le asigna carga positiva porque al llevarse a cabo la reducción, los electrones migran de él hacia los iones positivos, lo que provoca una disminución de electrones y la consecuente adquisición de una carga positiva
Es muy importante tener en cuenta que la corriente eléctrica del circuito externo de la celda voltaica consta de los electrones que se desplazan del electrodo negativo (ánodo) hacia el electrodo positivo (cátodo)