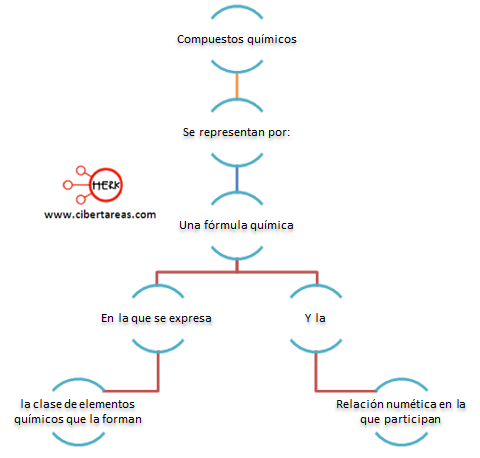
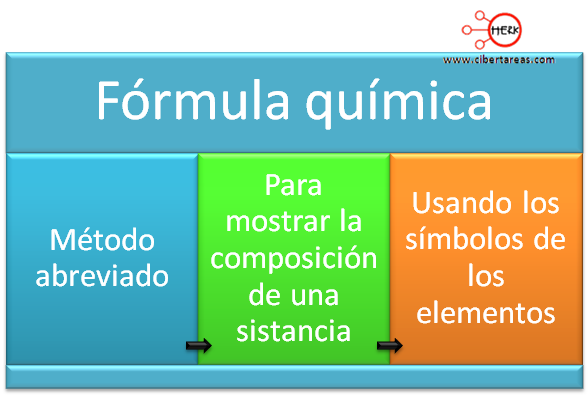
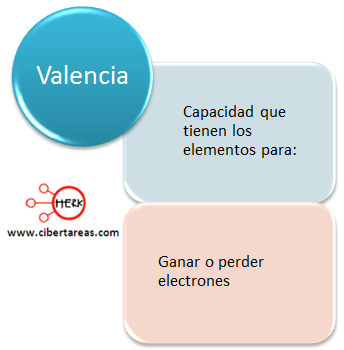
Compuestos químicos – Química 1
Podemos definir como:
Como ejemplo podemos poner:
Formula del agua:
(H2O), esta fórmula nos expresa que está constituida por dos átomos de hidrogeno y uno de oxígeno.
Formula del sulfato de potasio:
(K2SO4), esta fórmula nos dice que se tienen 2 átomos de potasio uno de azufre y cuatro de oxígeno.
Para poder escribir una formula química, debemos considerar que en la formula química existe una intervención de un ion positivo, llamado catión y un ion negativo llamado anión. Los iones se forman cuando los átomos ganan o pierden electrones y los metales tienen a perder electrones, los cuales se convierten en iones positivos o cationes, y viceversa, los no metales tienen a ganar electrones formándose en iones negativos o aniones.
Por si mismos, los átomos no forman iones pero con frecuencia se llegan a formar cuando se combinan metales con no metales.
Existe una capacidad en los elementos:
Es importante mencionar que la valencia generalmente coincide con el grupo al que pertenece, es muy preciso para los elementos representativos con valencia de 1, 2, 3.
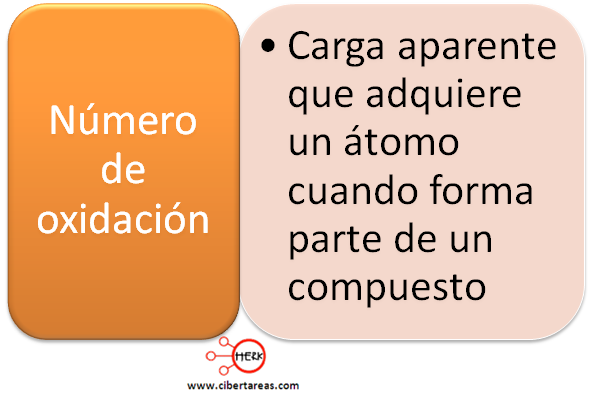
Pero tanto los grupos A como B llegan a tener más de una valencia, cuando esto sucede estamos hablando de un numero de oxidación.
Este número es determinado por el compuesto donde se encuentra el elemento químico, este número puede tomar un valor positivo o negativo según el elemento con el que se combine. Ejemplo:
Oxigeno
Por lo general tiene un número de oxidación de 2-
Al combinarse con el flúor, el número de oxidación cambia a 2+
Este resultado de cambio de negativo a positivo es resultado de la electronegatividad.
Para determinar el número de oxidación de un elemento se siguen varias reglas:
1.- El número de oxidación de los metales en los compuestos es igual a su valencia iónica (alcalinos 1+, alcalinos-térreos 2+)
2.- El número de oxidación del hidrogeno es 1+, excepto en los hidruros metálicos donde es 1-
3.- La suma algebraica de los números de oxidación de todos los átomos de un compuesto es igual a 0.
4.- El número de oxidación de un elemento libre es 0.
5.- El número de oxidación de un ion es igual a su carga.
6.- El número de oxidación del oxígeno es 2-, excepto en los peróxidos ya que su número es 1-, con el flúor, el número de oxidación de 2+
Para saber con precisión el número de oxidación que tiene un elemento en un compuesto, estas reglas nos ayudaran para conocerlo.