Geometría molecular y polaridad – Química 1
Al estudiar las propiedades físicas y químicas de los compuestos, se desecha la posibilidad de que las moléculas son lineales o que se estructuran con enlaces formando ángulos rectos.
Existe un modelo que explica las repulsiones, y se le conoce como repulsión de pares de electrones de la capa de valencia (RPECV), este modelo indica si la geometría de la molécula es lineal, trigonal plana, tetraédrica u otra.
Debemos de considerar que las cargas del mismo signo se repelen, los electrones que no participan en el enlace son los que influyen en la geometría molecular, esto se da cuando buscan la posición más alejada de los demás pares de electrones no enlazantes.
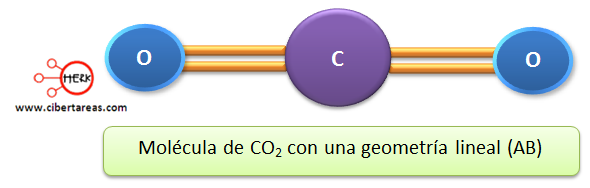
Al analizar algunos compuestos como el SO2 y el CO2, se encontró que tienen un átomo central y dos átomos a los lados, esto representa una geometría lineal, ya que los pares de electrones no enlazantes tienden a alejarse lo más posible entre sí, esto genera un ángulo de 180°, entendiendo como electrones enlazantes a aquellos que tienen la misma carga negativa.
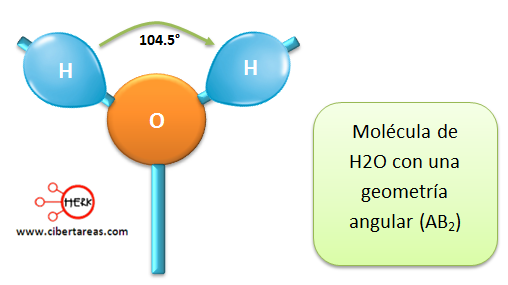
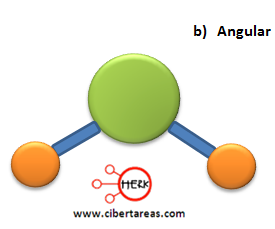
Existen otros compuestos como el H2O, este compuesto contiene dos enlaces de hidrogeno-oxígeno y también dos pares de electrones los cuales son no enlazantes y este pertenecen al átomo de oxígeno, esto ocasiona que la molécula de agua no sea lineal, ya que adopta una figura en forma de ángulo con abertura aproximada de 104.5°
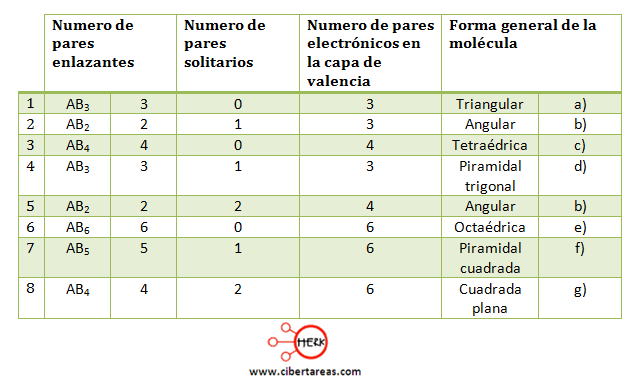
Para poder determinar cuál es la geometría molecular de algún compuesto, lo primero que se debe de hacer es saber cuántos enlaces presenta la molécula y cuantos pares de electrones no enlazantes rodean al átomo central.
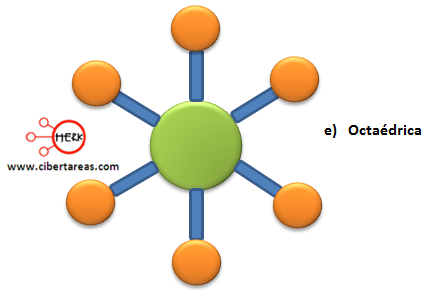
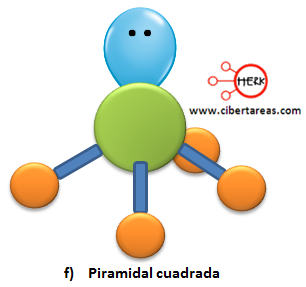
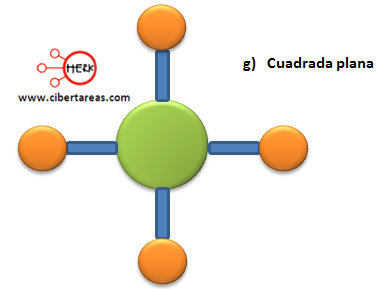
Veamos la siguiente tabla donde se describe la estructura molecular:
Ejemplo:
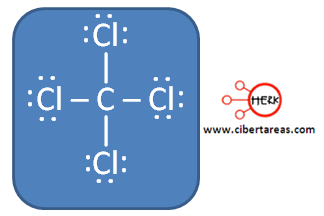
a) Para determinar la geometría molecular del tetracloruro de carbono (CCI4) es necesario:
1.- Dibujar la estructura de Lewis para el tetracloruro de carbono:
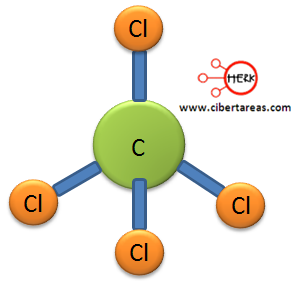
Podemos ver que el átomo de carbono ha formado cuatro enlaces y no le ha conservado ningún par libre, esto corresponde una estructura del tipo AB4, la geometría molecular corresponde es tetraédrica.
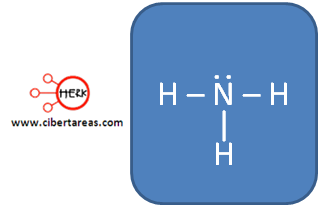
b) Para determinar la geometría molecular del amoniaco (NH3)
Para lograr la solución, primero es necesario determinar la estructura de Lewis:
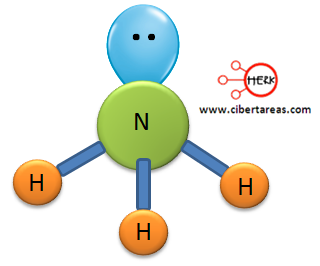
En este caso el nitrógeno forma tres enlaces y le queda un par libre, en este ejemplo se forma una geometría molecular AB3, La geometría del amoniaco es piramidal trigonal.





Luciana says:
Muy bueno, gracias por los ejemplos!