Potencial estándar de reducción en Temas selectos de química 2
Debemos considerar que la celda voltaica al funcionar genera un cierto voltaje, al cual se le ha dado d nombre de potencial de celda (E0) y su valor se determina al restar el potencial del ánodo del potencial del cátodo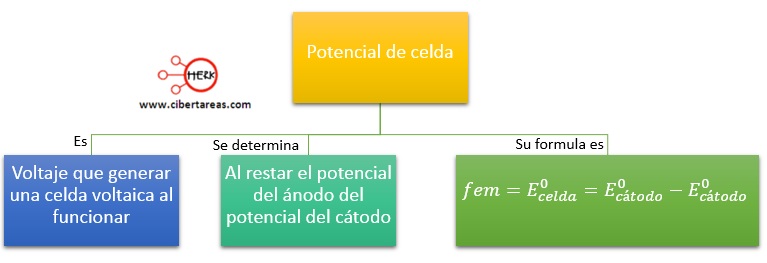
Para determinar el potencial de celda, uno de los métodos más empleados consiste en:
-Establecer el potencial estándar de reducción (E0)
-Las condiciones estándar a las que se toma la medida del potencial son:
-Temperatura de 25°C, si se trata de un gas
-Presión de 1 atm
-Concentración del ión a 1.0 M
La media celda de referencia se hace con iones H+ y una concentración 1.0 M, con hidrógeno gaseoso a 1 atm de presión y un electrodo de platino cuya superficie no es lisa sino que se encuentra, de alguna manera “granulada” para que la superficie de contacto sea mayor
A esta celda de referencia se le denomina electrodo estándar de hidrógeno y se representa como EEH
El diagrama de celda para el EEH es:
Tenemos que las dos medias celdas se interconectan mediante un puente salino y se coloca voltímetro en el circuito externo a la celda voltaica
Si la sustancia en análisis presenta un mayor potencial de reducción que la del ión hidrógeno, la corriente circulará en una dirección e indicará el potencial de celda en el voltímetro
Si por ejemplo, una segunda media celda de hidrógeno se conecta a la primera, entonces el potencial de celda será igual a cero
Lo anterior significa que no hay diferencia de potencial entre las dos medias celdas y por ello no hay corriente eléctrica circulando a través del circuito
Una vez que me reemplaza la media celda de hidrógeno por la media celda de la sustancia cuyo potencial se desea determinar, se produce una diferencia de potencial que el voltímetro registrará enseguida
Si la sustancia en estudio se reduce con mayor facilidad que el hidrógeno, el voltaje será positivo
El signo representa la dirección del flujo de electrones y además indica en cuál de las medias celdas se está llevando a cabo la reducción o la oxidación, si la sustancia en estudio se reduce más fácilmente que el hidrógeno, en la media celda del hidrógeno se llevará a cabo la oxidación; por el contrario, si la sustancia que se compara se reduce con mayor dificultad que el hidrógeno, entonces la reducción se llevará a cabo en la media celda del hidrogeno y la oxidación en la media celda correspondiente a la otra sustancia, por lo que el flujo de electrones se invertirá y mostrará un voltaje con signo negativo
Para entender mejor lo anterior, veamos el siguiente diagrama de celda: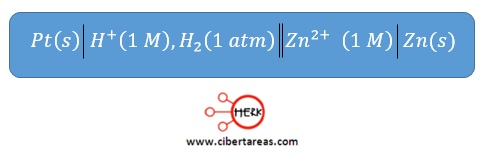
Cuando se cierra el círculo, el voltímetro registra una lectura de 0.763 V y la aguja se mueve hacia la izquierda a partir del punto cero, lo cual se interpreta corno -0.763 V
Así, el potencial estándar de reducción para el ion zinc será:
Al reemplazar la media celda de zinc por una media celda de cobre, obtendremos el siguiente diagrama de celda: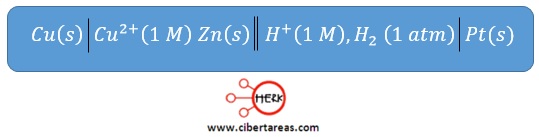
Con esto tenemos que ahora el voltímetro registra una lectura de 0.337 V y la aguja se mueve a la derecha, por lo que interpretamos el valor como +0.337 V para el ion cobre y podemos escribir:
Ejemplo
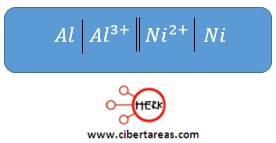
-Se ha construido una celda voltaica con un compartimiento en el que se coloca una tira de aluminio inmersa en una disolución de Al(N03)3 y otro que contiene una tira de níquel en una disolución de NiSO4
-La reacción global de la celda es:
-Con lo anterior surgen varias preguntas:
-¿Cuáles son las dos medias ecuaciones de las reacciones que se producen en los dos compartimentos?
-¿Cuál electrodo es el ánodo y cuál es el cátodo?
-¿Cuáles son los signos de los electrodos?
-¿Cuál es el diagrama de la representación simplificada de la celda correspondiente?
Solución
-A partir de la reacción global se identifica las medias reacciones de oxidación y reducción en las cuales se incluyen los electrones necesarios para equilibrar las cargas:
-Al recordar la relación ánodo-oxidación y cátodo-reducción, es evidente que la tira de aluminio (que es el compartimento donde se lleva a cabo la oxidación) es el ánodo y por tanto la tira de níquel es el cátodo
-El ánodo tiene el signo negativo y el cátodo, positivo