Entalpía de formación – Química 1
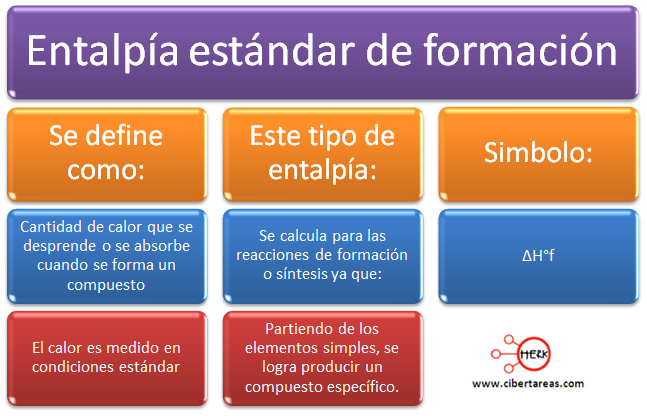
Es importante destacar que la variación de entalpia que se produce durante las reacciones a presión constante, esto expresa la diferencia entre las entalpias de los productos y los reactivos, para esto se ha convenido asignar a cada sustancia un valor constante, este valor recibe el nombre de entalpía estándar de formación.
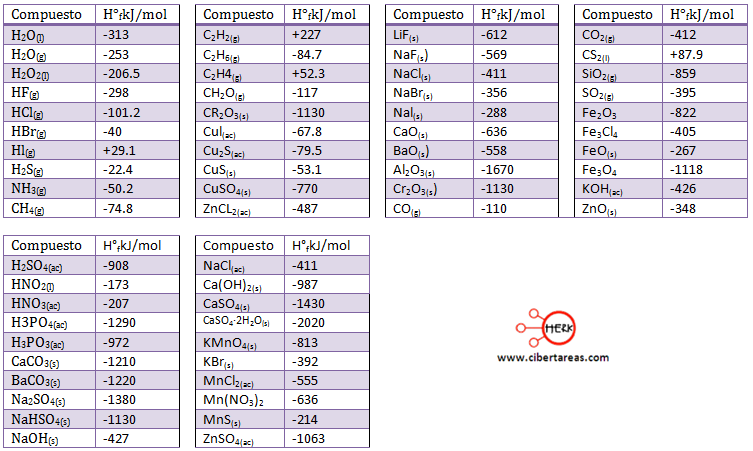
Para esto se ha realizado la tabulación de las entalpias estándar de formación de los compuestos para calcular a partir de ellas las entalpias estándar de reacción.
Veamos el siguiente ejemplo:
Es necesario determinar el calor generado en la reacción de combustión del etano a 25°C y con 1 atm.
La ecuación es:
1.- De la tabla anterior, se toman los datos de la entalpia de formación, esto se hace para cada uno de los compuestos, debemos considerar que los elementos sin combinar tienen ΔH°r = 0.
2.- El valor de la entalpia de formación se multiplica por el coeficiente que cada sustancia presenta en la ecuación balanceada, debemos de considerar la regla de los signos, entonces tenemos:
Al observar el resultado, el signo negativo muestra que la reacción es exotérmica y para este caso el calor numérico indica que se libera gran cantidad de calor.