La fuerza de los ácidos y de las bases en Temas Selectos de Química 2
Existen unas consideraciones importantes sobre la fuerza de ácidos y bases, al igual que otros electrólitos, los ácidos y las bases también pueden ser fuertes o débiles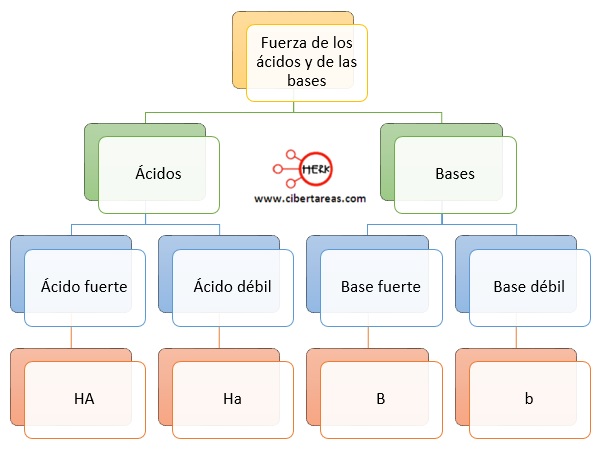
Ácido fuerte (HA)
-Es aquel que cede H+ con facilidad y en disolución está totalmente disociado: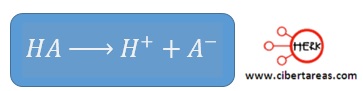
-Cuando el ácido sulfúrico (H2SO4) se disuelve en agua, se disocia completamente, considerándose por tanto un ácido fuerte
-La flecha de reacción que se dirige exclusivamente a la derecha tiene ese significado: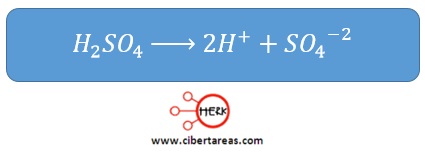
Ácido débil (Ha)
-Cede sus H+ con dificultad y se disocia muy poco en disolución
-Una manera de indicar este fenómeno es la inclusión de la doble flecha en la reacción: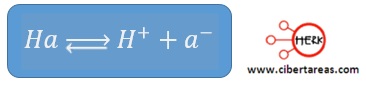
-El ácido acético es un ejemplo de ácido débil que se distorsiona muy levemente
Base fuerte (B)
-Es aquella que acepta los H+ con facilidad y, en presencia de una cantidad de una cantidad suficientes de ellos, capta todos los protones que requiere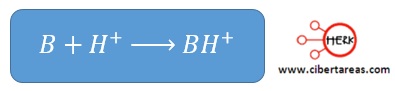
Base débil (b)
-Acepta con mucha dificultad los H+ y recibe por la misma razón, menos protones que la base fuerte: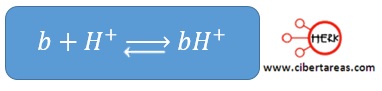
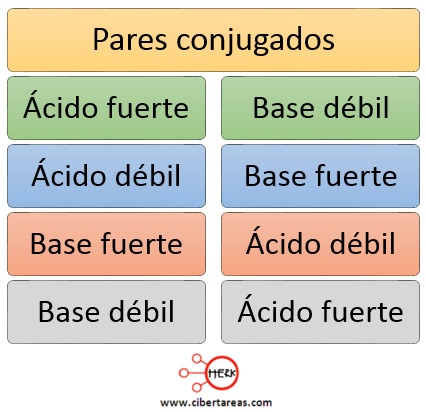
Es importante mencionar que cuando un ácido fuerte está disociado por completo, su base conjugada no acepta protones con facilidad, se comporta entonces como una base débil
Y tenemos que a la inversa, un ácido débil tendrá, como contraparte, una base fuerte que acepta protones con facilidad
A manera de resumen, los pares conjugados ácido-base incluyen parejas ácido fuerte-base débil, y viceversa, base fuerte-ácido débil