Par conjugado ácido-base en Temas Selectos de Química 2
Hay que considerar que en las reacciones ácido-base que se desarrollan en disoluciones acuosas, la teoría de Brönsted-Lowry tiene una importancia peculiar, por ejemplo:
-Cuando el cloruro de hidrógeno gaseoso se disuelve en agua, se forman iones: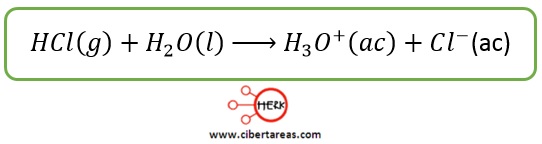
En la reacción anterior:
-El cloruro de hidrógeno es un ácido y el agua, una base
En el proceso, el ión hidrógeno proveniente del cloruro de hidrógeno se ha hidratado para formar el ión poliatómico denominado hidronio (H30+)
Este ión se considera como la hidratación del protón desprendido por la molécula ácida
Con respecto a esto, existe fuerte evidencia de que el ion hidrógeno rara vez se encuentra libre como H+
Sucede, más bien, que el protón es fuertemente atraído por los electrones de las moléculas de agua que lo circundan, formándose así, de manera inmediata, el ión hidronio
Si consideramos la reacción opuesta tenemos: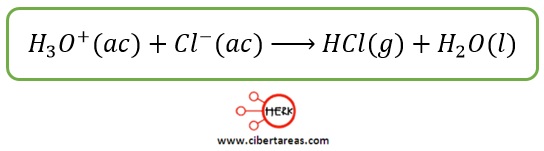
Observemos que el ion hidronio funge como ácido de Brönsted-Lowry al donar un protón al ión cloruro, que a su vez actúa como una base de Brönsted-Lowry al aceptar un protón
Al donar su protón, el ión hidronio produjo una base:
-Agua
Mientras que el ion cloruro al aceptar el protón, dio puso a la formación del cloruro de hidrógeno, un ácido
A este tipo de combinaciones se les denomina en el ámbito de esta teoría:
-Par conjugado ácido-base
En este ejemplo se pueden identificar dos pares conjugados ácido-base:
-El primer par conjugado:
-Constituye el hidronio (ácido conjugado 1) y el agua (base conjugada 1)
-El segundo par conjugado:
-Incluye al ión cloruro (base conjugada 2) y al cloruro de hidrógeno (ácido conjugado 2)
Se puede generalizar este concepto para diversas sustancias si se utiliza el símbolo HA para el donador de protones disuelto, y el símbolo A– para representar al anión: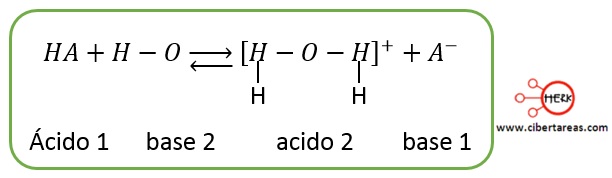
A manera de resumen tenemos que:
-Un par conjugado ácido-base difiere tan solo en la presencia o ausencia de un protón
-Todo ácido tiene una base conjugada que se forma quitando un protón al ácido y análogamente, toda base tiene un ácido conjugado que se a forma añadiéndole un protón a la base
Si al ácido sulfhídrico (H2S) le quitamos un protón, obtenemos su base conjugada:
-HS–
Asimismo, si al ión cianuro (CN–) que se comporta como una base, le añadimos un protón, obtendremos el ácido conjugado correspondiente:
-HCN

