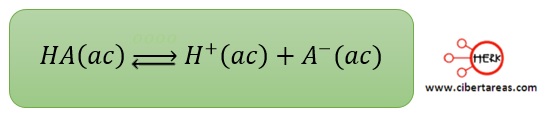Constante de ionización en Temas Selectos de Química 2
Debemos saber que existe una formad e medir cuantitativamente la fuerza de un ácido o de una base, sobre todo si se toma en cuenta que la fuerza de un ácido o de una base esta en función de cuanto puede disociarse
Es necesario escribir expresiones que permitían calcular la constante de equilibrio para una reacción determinada
Consideremos la siguiente expresión como el esquema para la disociación de una acido débil en medio acuoso: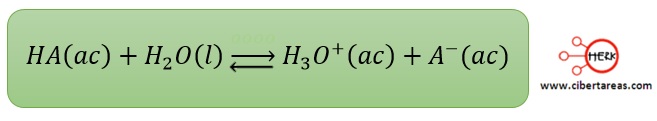
La expresión para la constante de equilibro será: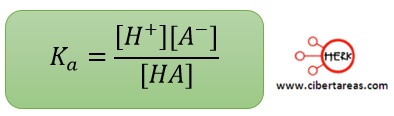
Para denotar que se trata de un ácido, se puede cambiar Keq por Ka, a la cual se le conoce como constante de disociación acido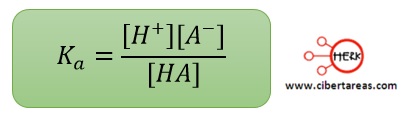
La magnitud de Ka indica la tendencia del ácido a ionizarse en agua, de tal manera que mientras más grande se su valor, tanto más fuerte será el acido
Al comparar, por ejemplo:
-Valor de Ka del ácido arsénico (H3AsO4) con el calor de Ka del ácido cético (CH3COOH), se puede observar que el primero es más fuerte que el segundo porque los valores respectivos son 5.8 x 10-3 y 1.75 x 10-5
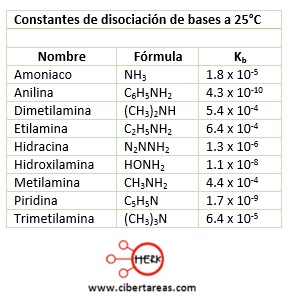
En la siguiente tabla se concentran los valores de Ka para diversos ácidos: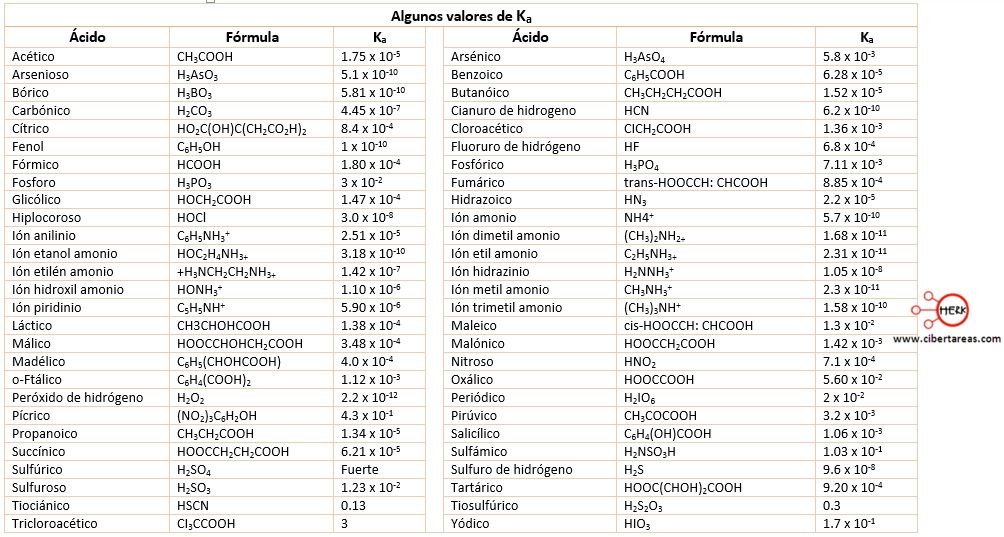
Al conocer el valor de Ka y la concentración del ácido, se puede calcular con un procedimiento sencillo, la concentración de los iones producidos
Ejemplo
-Es necesario calcular la concentración de iones hidrogeno [H+] en una disolución 0.00035 M de ácido acético
Solución
1.- Se escribe la ecuación de disociación
2.- A partir de esta ecuación se anota la expresión para la constante de disociación acida y se toma de la tabla su valor respectivo:
Para efectuar el análisis adecuadamente conviene considerar las condiciones iniciales, lo que sucede en el cambio y lo que pasa al establecerse el equilibrio, tenemos que:
Al sustituir la expresión de la constante de disociación acido, efectuando previamente una consideración importante, ya que la disociación del ácido acético es verdaderamente mínima, la concentración inicial de ácido acético permanece inalterada, entonces e puede escribir:
Tenemos que el pequeño valor obtenido para [H+] indica que se trata de un ácido débil
De forma análoga se puede proceder a cálculo de la concentración de iones OH–, es decir, la fuerza de una base, si conocemos el valor de la constante de disociación básica, Kb
Ejemplo
-Se ha preparado una disolución de 0.010 M de amoniaco de agua
-Es necesario determinar la concentración de iones hidroxilo presentes en la disolución
Solución
Se escribe la ecuación de disociación para el amoniaco (NH3), que como es una base forma su acido conjugado añadiéndole un protón, y se obtiene así el ion amonio: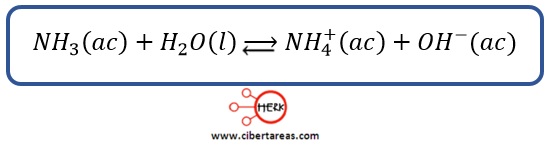
Al omitir el agua por ser el disolvente, y la expresión para constante de disociación básica será: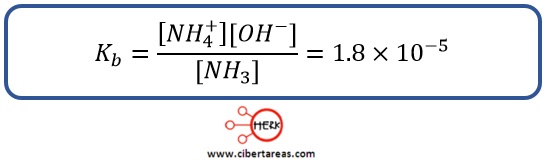
Se efectúa el análisis del comportamiento del proceso: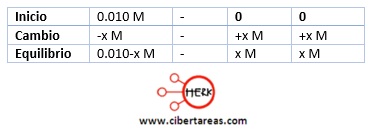
Como es una base débil, su disociación tiene valores muy pequeños, por lo que para simplificar los cálculo, la concentración final en el equilibrio será, con una fuerte aproximación, la misma que se tenía inicialmente, por ello:
Sustituyendo en la expresión para Kb y resolviendo, obtenemos el resultado: