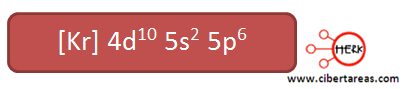Grupo y periodo de la tabla periódica – Química 1
Moseley ayudo de gran manera con sus descubrimientos a establecer la ley periódica, la cual nos indica que:
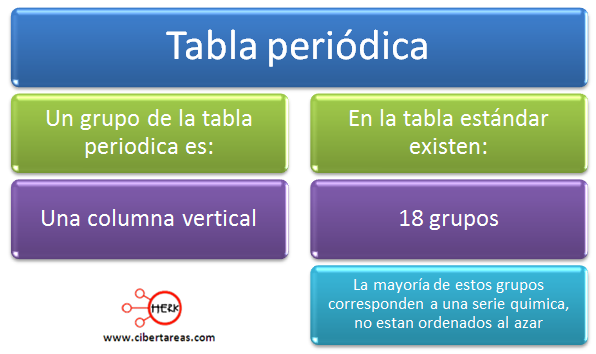
Con esta ley se ha organizado a los elementos químicos por su número atómico, en grupos y periodos.
La tabla periódica se desarrolló para organizar las series químicas conocidas, todo esto debe de estar en un esquema coherente, tenemos que la distribución de los elementos dentro de la tabla periódica se lleva a cabo a partir de los grupos que tienen la misma configuración electrónica en su capa más externa.
La interacción existente en los electrones, determinan el comportamiento químico, con esto tenemos que los elementos de un mismo grupo tengan similares propiedades físicas y químicas.
Podemos mencionar al primer grupo:
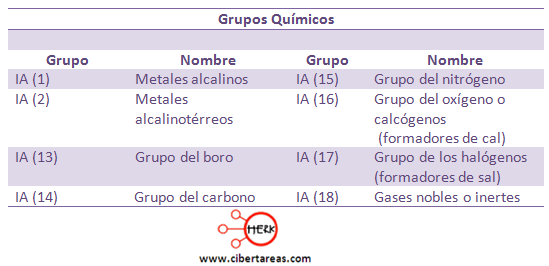
Se conoce como IA o grupo 1, este es el grupo de los metales alcalinos, incluye:
Estos tienen un solo electrón en la capa más externa y son metales altamente reactivos y estos metales son altamente reactivos que se combinan con facilidad para formar óxidos o hidróxidos.
Los grupos marcados con la letra A se les denominan representativos, entre sus características tenemos:
-Su última capa electrónica o capa de valencia tiene orbitales s y p
-Y este grupo va del IA al VIIIA
Tenemos a los grupos que están identificados o marcados con la letra B, estos:
-Corresponden a los elementos de transición y su orbital más externo es de tipo d
-Van del IB al VIIIB
Tenemos a los lantánidos y actínidos, a estos grupos e le conoce como tierras raras, muchos de ellos han sido sintetizados y no se encuentran en la naturaleza.
Ejemplo:
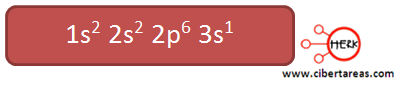
1.- Elemento potasio.
Configuración electrónica:
Tenemos que el electrón diferencial del potasio se ubica en el orbital 3s correspondiente al tercer nivel energético
En consecuencia esta ubicado en el tercer periodo.
2.- Elemento xenón (gas noble)
Numero atómico 54
La configuración electrónica de este elemento, utilizando el kernel es:
El electrón diferencial del azufre está ubicado en el orbital 5p, este corresponde al quinto nivel energético, con esto se puede ubicar en el quinto periodo de la tabla.
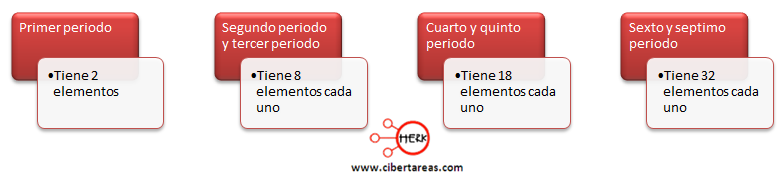
Cuando se observa la tabla periódica se pude notar que el número de elementos de cada periodo no es el mismo:
Para que la representación sea más fácil, existen dos filas horizontales fuera de la tabla, las cuales corresponden a los elementos que deberían de ir en el sexto y séptimo periodo, a la primer fila de esta serie de elementos comienza con el lantano, por lo que se les denomina lantánidos (tierras raras, se encuentran en forma de óxidos), pertenecen al sexto periodo.
En la segunda fila, se encuentran los actínidos (elementos de transición interna), pertenecen al séptimo periodo.