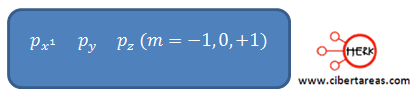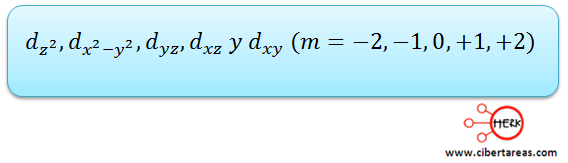Orbitales atómicos – Química 1
Cuando se ha solucionado la ecuación de Schrödinger, se tiene como resultado cuatro tipos de orbitales diferentes, estos son designados con las letras:
Tenemos que las propiedades de los elementos y los compuestos dependen de los electrones de dicho elemento y más propiamente de los que se encuentran en los niveles de energía más externa.
Es muy importante conocer el tipo de orbital donde se encuentran los electrones.
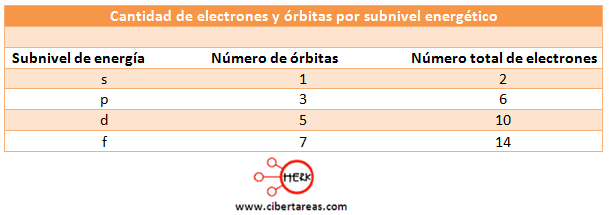
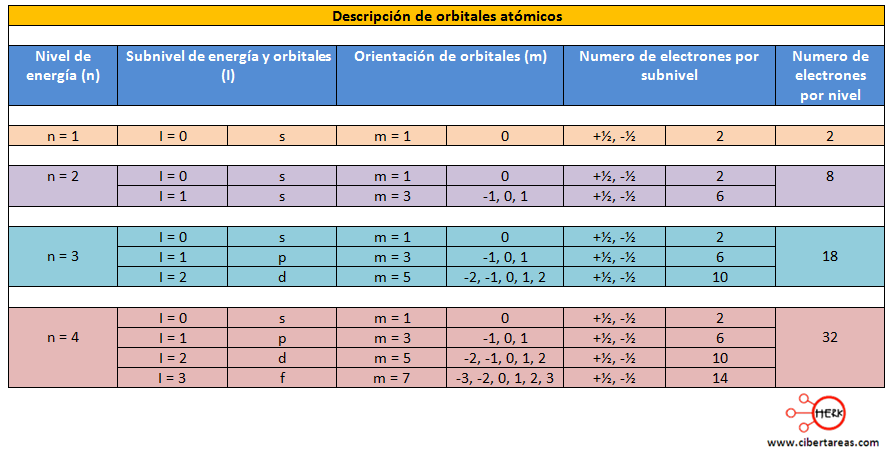
Los orbitales pueden contener un número determinado de electrones, considerando que el número cuántico espín (s) nos indica que un electrón gira en el sentido de las manecillas del reloj y el otro en sentido contrario, tenemos que solo puede haber dos electrones por orbita, veamos el cuadro siguiente:
Orbital s
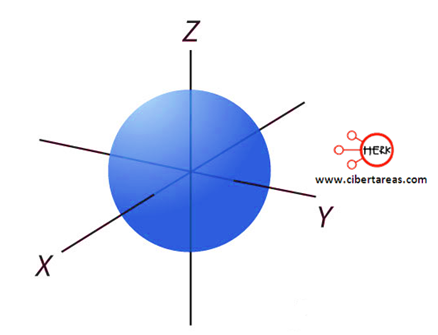
Este orbital, tiene un valor de l = 0 y es de forma esférica
El tamaño de los orbitales s y su energía será mayor o menor, esto según el valor del número cuántico principal, para cada valor de n hay un único orbital s
Orbital p
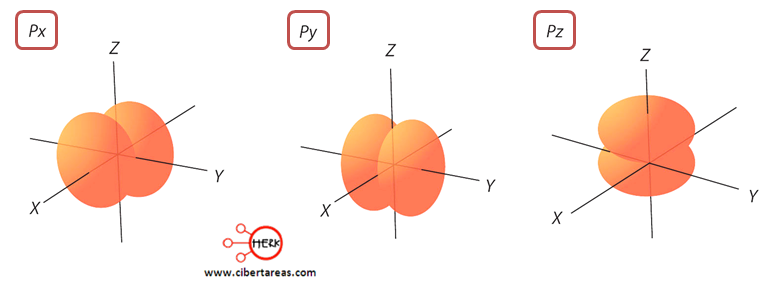
Este orbital, presentan un valor de I = 1, con una forma de lóbulos.
Los orbitales p tiene un plano imaginario que corta el núcleo y divide la región de densidad electrónica a la mitad.
A este plano resultante, se le llama plano nodal.
Existen tres tipos de orbitales p de idéntica forma lo único que cambia es su orientación en el espacio
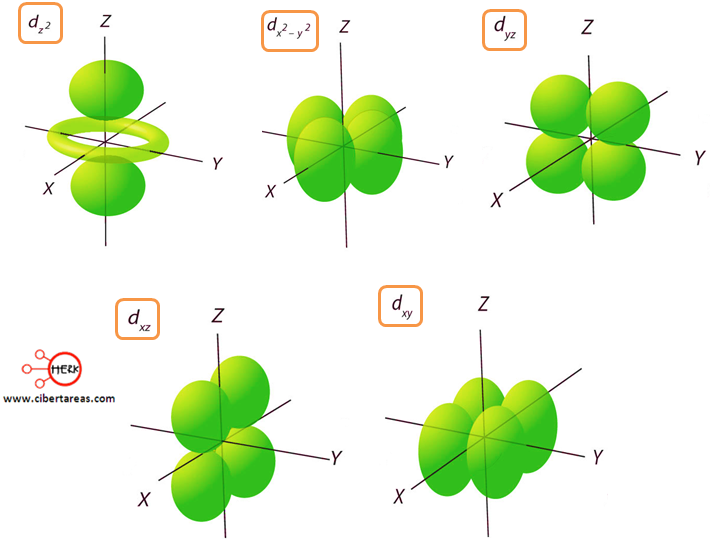
Orbital d
Este orbital tiene un valor de I = 2 y a su vez tiene forma de lóbulos.
El orbital d, tiene una disposición más complicada que en los orbitales p, lo que da a lugar a cuatro regiones de densidad electrónica.
Existen cinco orbitales d
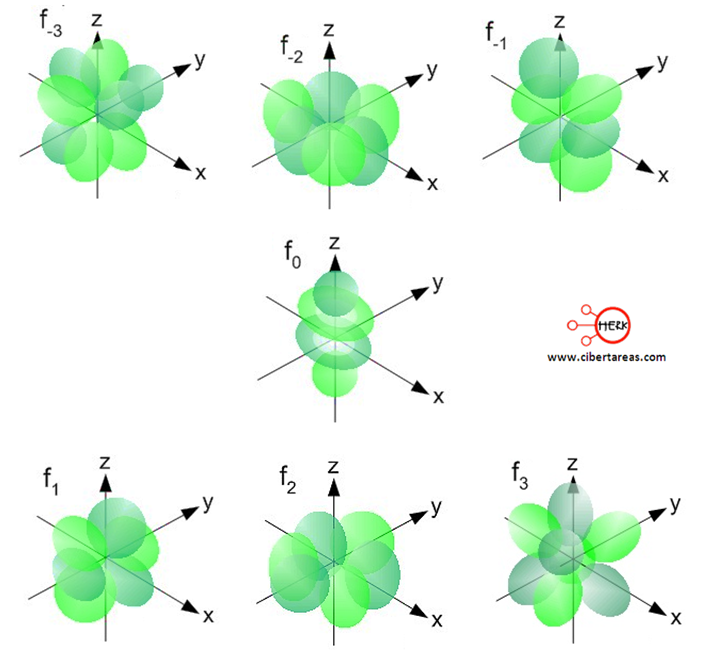
Orbital f
Este orbital, tiene un valor de l = 3 y presenta un aspecto multilobular.
En el siguiente cuadro veremos un resumen de los cuatro números cuánticos, esta información puede ser aplicada en la configuración electrónica.