Teoría de Brönsted-Lowry en Temas Selectos de Química 2
Brönsted y Lowry propusieron, cada uno de forma independiente, una teoría que mejora significativamente la propuesta de Arrhenius, debido a que esta última se limita a las disoluciones acuosas y se han encontrado reaccione ácido-base que se verifican en fase gaseosa o en solventes distintos al agua (como es el caso del amoniaco y el cloruro de hidrógeno) que reaccionan en fase gaseosa para formar una sal (cloruro de amonio)
La definición de Brönsted-Lowry sostiene que:
-Ácido
-Cualquier especie química que puede donar un protón (H+), es decir, un átomo de hidrógeno sin su electrón
-Base
-Una especie química capaz de aceptar un protón
-Reacción ácido-base
-Aquella en la que el ácido transfiere un protón a una base
Retomando la relación de ejemplo se tiene que: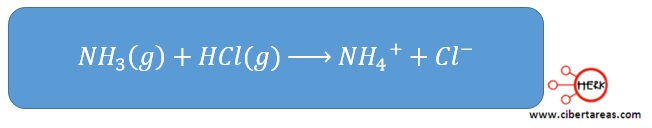
Donde el amoniaco recibe un protón del cloruro de hidrógeno y se comporta como una base de Brönsted-Lowry, mientras que el cloruro de hidrógeno al donar un protón se comporta como un ácido de Brönsted-Lowry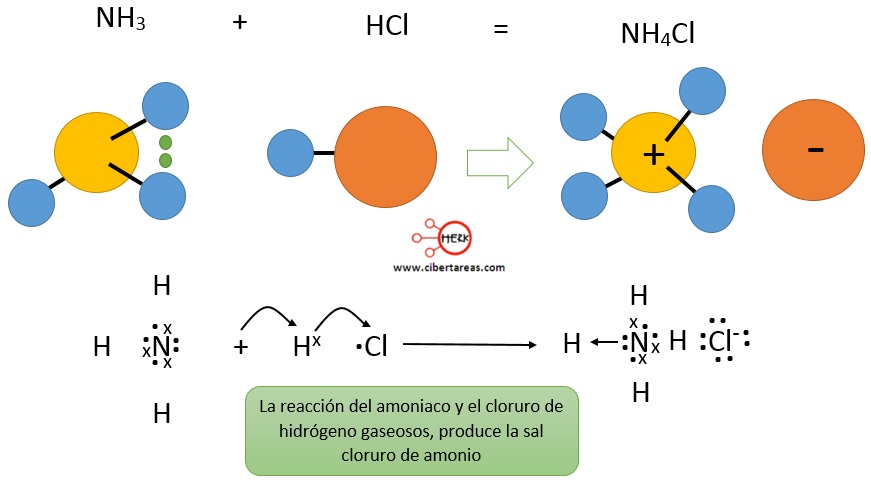
En la figura anterior se puede observar que, al efectuarse el proceso:
-El protón del cloruro de hidrógeno se une mediante enlace covalente con el par de electrones no compartido del amoniaco
En general, para que una sustancia actúe como ácido de Brönsted-Lowry es necesario que el hidrógeno esté unido a un átomo más electronegativo que él, y en el mismo sentido, para que una sustancia actúe como una base de Brönsted-Lowry, es requisito indispensable que posea un par de electrones no compartido con el cual pueda establecerse el enlace covalente con el protón