La teoría de Lewis en Temas Selectos de Química 2
Debemos saber a manera de introducción que la teoría ácido-base de Arrhenius se basa en la disociación que se realiza en estas sustancias cuando se encuentran en disoluciones acuosas
En esta definición los ácidos son aquellas sustancias capaces de producir, en disoluciones acuosas iones hidrogeno y por otra parte, las bases, en las mismas condiciones, producen iones hidroxilo
La teoría de Brönsted-Lowry ampliar el concepto de ácidos y bases, postulando la figura de donadores o aceptadores de protones, para lo cual no se requiere, necesariamente, un medio acuoso
Entonces una sustancia se considera ácida cuando es capaz de donar protones y básica cuando acepta protones, independientemente del medio en el cual se realice tal proceso
Resumiendo lo anterior, tenemos que ambas teorías, aunque difieran en varios aspectos, coinciden en uno muy importante:
-El comportamiento ácido o base de una sustancia se considera a partir de la participación de los protones
Entonces, el químico norteamericano, Gilbert N. Lewis, ampliamente conocido por su teoría del enlace covalente, sustenta una nueva teoría aplicable a los ácidos y a las bases:
Con su teoría Lewis logra un avance significativo frente a la teoría de Brönsted porque se aplica a disoluciones y reacciones donde ni siquiera participan el hidrógeno y el oxígeno
Ejemplo:
-La reacción entre el trifluoruro de boro y el amoniaco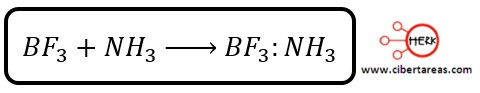
-Cuya representación mediante estructura de Lewis es la siguiente: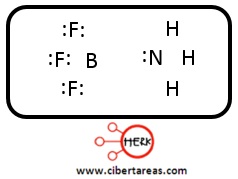
El BF3, posee un orbital capaz de albergar un par de electrones y en la reacción considerada es un ácido de Lewis
El amoniaco puede ceder el par de electrones no compartido y comportarse, así, como una base de Lewis
Las reacciones siguientes sirven para para ilustrar el concepto acido-base de Lewis: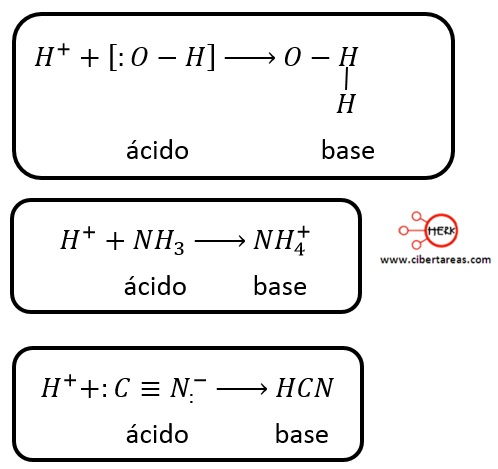
Hay que considerar que una de las ventajas del concepto de Lewis es:
-Identifica como ácidos a ciertas sustancias que no contienen hidrogeno y que tienen la misma función que los ácidos comunes que contienen hidrogeno
Como ejemplo de lo anterior tenemos las siguientes reacciones:

