Los aspectos cuantitativos de la electrolisis en Temas Selectos de Química 2
Tenemos que las medias reacciones informan la cantidad de electrones que son necesarios para llevar a cabo un proceso electrolítico
Por ejemplo:
-Para llevar a cabo la reducción del catión litio es necesario un solo electrón:
-En el caso del catión cadmio 2+, la reducción implicara dos electrones:
Entonces tenemos que de acuerdo a las medias reacciones, para lograr la deposición de 1 mol de litio será necesario utilizar un mol de electrones y para lograr depositar 1 mol de calcio serán necesarios 2 mol de electrones
En consecuencia, puede afirmarse que para toda media reacción, la cantidad de sustancia que se reduce o se oxida en una celda electrolítica es proporcional al número de electrones que se introducen en la celda
Entonces, la cantidad de electricidad que pasa por un circuito eléctrico, como es el caso de una celda electrolítica, se mide coulomb, que se abrevia por la letra C y cuya definición es: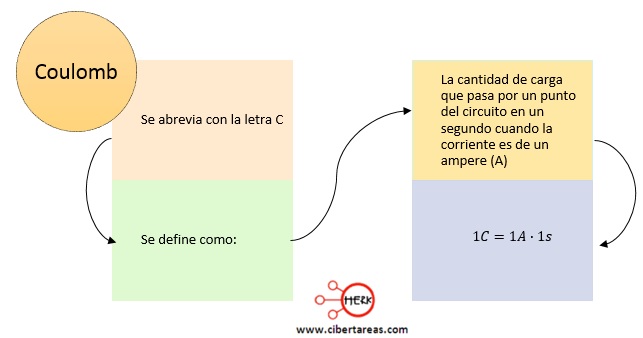
La carga de 1 mol de electrones se conoce como faraday (F) y su equivalencia en coulombs es la siguiente:
A manera de resumen, para obtener la deposición de 1 mol de un elemento monovalente será necesario utilizar 1 F; si fuese el caso de un elemento trivalente, requeriríamos 3 F, etc.
Ejemplo de aplicación de estos conceptos
-Se necesita electrolizar una disolución de Cr3+(ac) para lograrlo, se emplea una corriente de 7.75 A
-Primero, determinar qué masa de Cr(s) se habrá depositado al cabo de 1.5 días
-Segundo, es necesario calcular que amperaje se requiere para depositar 0.250 mol de Cr(s) de una disolución de Cr3+ en un periodo de 8 horas
Solución
En primera instancia, se calcula los coulombs de carga eléctrica que se están introduciendo a la celda electrolítica, la fórmula es:
Enseguida se determina, valiéndose de la definición del faraday (1 mol e– = 96 500 C), los moles de electrones que se introducen a la celda:
Se escribe la media ecuación de reducción y a continuación se calcula tanto los moles de Cr(s) como los gramos:
Ahora, se calculan los moles de e- necesarios para producir esta masa a partir del dato del problema (0.250 mol de Cr) y de la media ecuación correspondiente
A continuación se determina el total de Coulombs requeridos, utilizando para ello la definición del Faraday:

