Configuración electrónica del carbono – Química 2
Es importante mencionar que la extensa cantidad de químicos orgánicos presentes en la naturaleza es producto de la complejidad estructural del carbono, el cual contiene cuatro electrones de valencia libres para enlazarse con otros átomos, lo que le permite formar numerosos compuestos
La estructura de estos compuestos orgánicos puede variar desde un carbono unido a cuatro hidrógenos como en el caso del metano (CH4)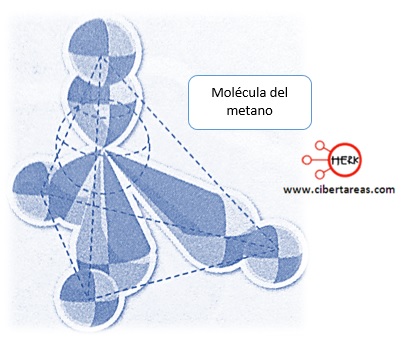
Pasando por largas cadenas de carbono unidas a hidrógenos como el n-nonano (C9H20) y hasta cadenas de carbonos unidos a grupos funcionales como el etilénglicol (C2H6O2), entre otras posibilidades
Una de las características más llamativas del carbono es el fenómeno de alotropía, que consiste en:
Entre las formas alotrópicas del carbono están:
-Carbón vegetal
-Grafito
-Diamante
Aunque muy recientemente se menciona como otra forma alotrópica el fullereno, la cual es una molécula de carbono con estructura parecida a un balón
Los usos del carbono son múltiples, por ejemplo:
-La concentración del isótopo carbono-14 presente en un objeto orgánico permite determinar su edad
-La combinación del grafito con arcilla sirve para fabricar las minas o puntillas de los lápices
-El diamante se emplea para la construcción de joyas
El carbono es parte esencial en:
-Fabricación de aceros y de varillas de protección en los reactores nucleares
-En la medicina, las pastillas de carbono se usan para absorber las toxinas del sistema digestivo
-El carbón activado se utiliza en los sistemas de filtrado y purificación del agua
-La fibra de carbono es un polímero formado por grafito que normalmente se emplea en combinación con algunas resinas, esta fibra presenta una resistencia fuera de lo común ya que puede llegar a ser más duro que el acero, además de que es más liviano y tiene múltiples aplicaciones, que van desde piezas para aviones o trasbordadores espaciales hasta raquetas de tenis o cañas de pescar
Actualmente se estudian:
-Las propiedades químicas y estructurales de los fullerenos y de los nanotubos de carbono, que consisten en arreglos de átomos de carbono, cuyos tamaños son unos cuantos nanómetros
-Los fullerenos son moléculas esféricas formadas solo por átomos de carbono, pueden servir corno una nueva generación de lubricantes, si se encuentran a temperaturas entre 10 K y 40 K, se comportan como superconductores
-En la medicina, un cierto metano fullenero es capaz de inhibir la proteasa del virus del sida esta aplicación prolongaría la vida de los enfermos infectados por el VIH-1 y VIH-2
Estas y otras propiedades se deben al acomodo interno del átomo de carbono, esta es la razón fundamental para que los científicos analicen cómo esta organiza desde el interior para entender por qué puede tener tantas aplicaciones y en ámbitos tan diferentes.
El carbono forma parte de todos los seres vivos, tanto en su estructura como en varias de sus funciones metabólicas, sus propiedades le permiten formar una cantidad superior de compuestos a la de cualquier elemento de la tabla periódica
Descripción química de un átomo de carbono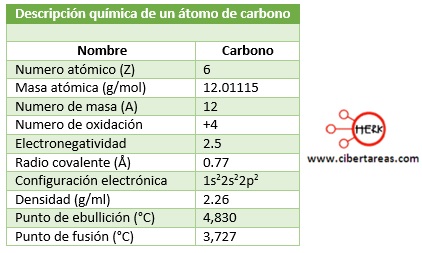
El átomo de carbono cuenta con seis electrones, por esta razón su configuración electrónica de estado basal o estado de mínima energía es 1s22s22p2
El diagrama energético de su estado basal es: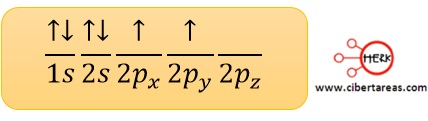
Los orbitales 1s y 2s se encuentran ocupados por completo, no así el orbital p, al cual le queda un suborbital por llenar
Al analizar la configuración electrónica de estado banal puede notarse que hay dos electrones desapareados en el orbital p, lo cual indica que el carbono podría establecer solamente dos enlaces
Sin embargo, se han efectuado análisis moleculares que han determinado que el átomo de carbono es tetravalente, en otras palabras tiene la capacidad para formar hasta cuatro enlaces y cada uno de ellos es similar en su extensión y energía a los otros tres, esto es posible gracias al fenómeno de hibridación de orbitales, un orbital híbrido es aquel que: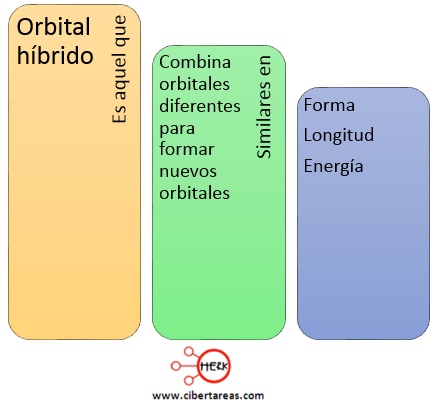
En el átomo de carbono se han encontrado tres tipos diferentes de hibridación: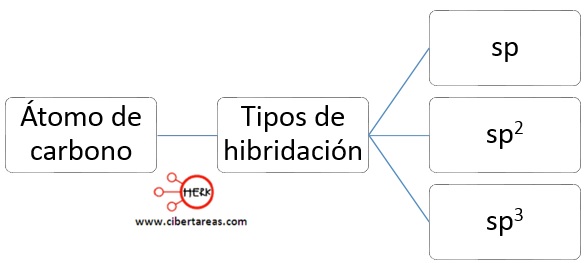
Hibridación sp3
-La configuración electrónica de estado basal o de mínima energía para el átomo de carbono es la siguiente:
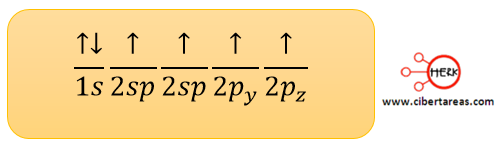
-Hay un estado intermedio conocido como estado excitado que da lugar a la hibridación sp3, esto significa que un electrón del orbital 2s migra o es promovido el suborbital p vacío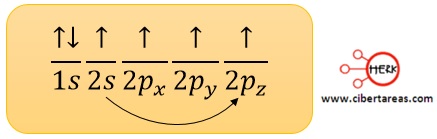

-En la imagen superior se aprecia que al combinarse el orbital 2s con los tres orbitales p, se obtienen cuatro orbitales híbridos sp3
-Finalmente se combina el orbital 2s con los tres orbitales p, por esta razón se denomina hibridación sp3, para dar lugar a cuatro orbitales híbridos sp3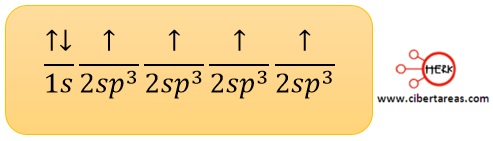
Hibridación sp2
-En este tipo de hibridación, posterior al estado excitado, se realiza la combinación de un orbital s con dos orbitales p
-El resultado son tres orbitales sp2 y queda disponible un suborbital p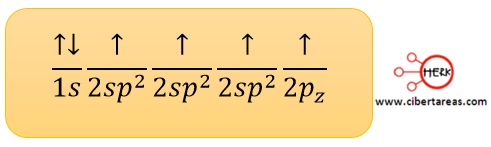
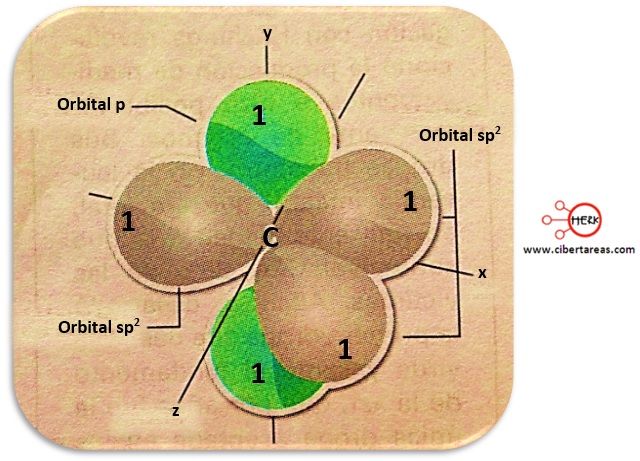
-En la imagen anterior tenemos que, perpendiculares a los tres orbitales híbridos sp2, se colocan los dos orbitales p
Hibridación sp
-Esta hibridación se genera por la combinación de un orbital tipo s y un orbital tipo p
-El resultado de esta combinación son dos orbitales híbridos
-Al mismo tiempo quedan libres dos suborbitales p que se colocan perpendicularmente a los dos orbitales híbridos sp