Disoluciones – Química 2
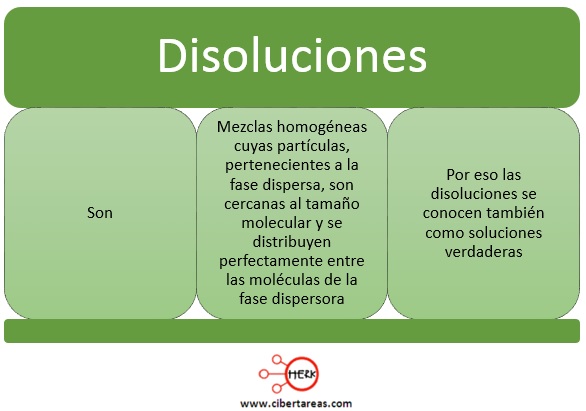
En una disolución:
-La fase dispersa se llama soluto
-La fase dispersora se llama solvente o disolvente
Tanto el soluto como el solvente pueden estar en cualquier fase:
-Sólida
-Líquida
-Gaseosa
Sin embargo la fase final de la disolución siempre será la del solvente
Un ejemplo de esto se observa cuando el solvente es el agua, prácticamente todo soluto capaz de disolverse en ella “desaparece” en su seno y el resultado final es una disolución líquida
Para que una disolución pueda llevarse a cabo se requiere, entre otras cosas, que tanto el soluto como el solvente posean polaridades similares, esto significa que una sustancia polar, como el agua, disuelve sustancias polares; mientras que una sustancia no polar como el benceno, lo hace con sustancias no polares, como la parafina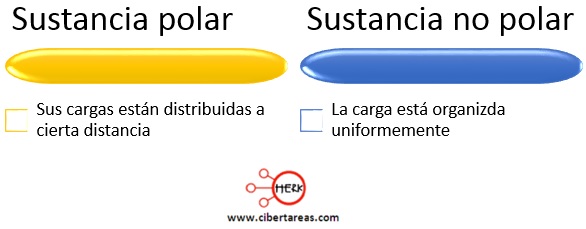
Algunas de las propiedades físicas de las disoluciones se alteran conforme aumenta o disminuye la concentración de soluto disuelto, dichas propiedades se conocen como coligativas y entre ellas se encuentra:
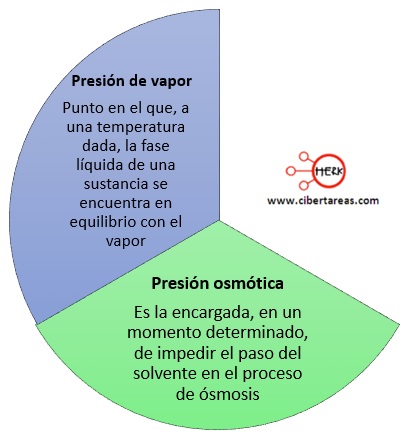
-Disminución de la presión de vapor del solvente
-Disminución del punto de congelación
-Aumento del punto de ebullición y la presión osmótica de la solución
Las propiedades coligativas tienen un amplio campo de aplicación, por ejemplo:
-En la refrigeración de los motores de automóviles, se adiciona anticongelante, que consiste en una solución de etilenglicol, que al añadirse al agua provoca un aumento del punto de ebullición y una disminución del punto de congelación, con lo cual el funcionamiento del vehículo soporta algunas condiciones extremas de calor o frío sin dañarse
Las disoluciones desempeñan funciones especiales en los seres vivos, como se evidencia en el fenómeno de la ósmosis