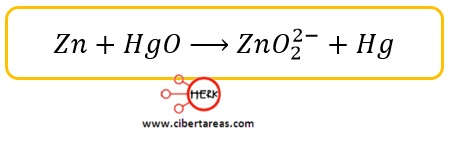
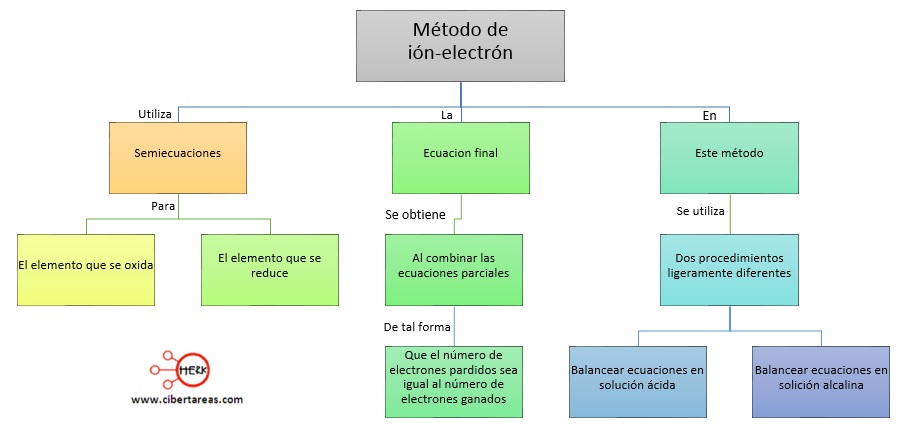
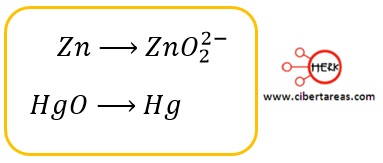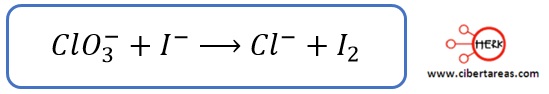Reglas para determinar el número de oxidación en Temas Selectos de Química 2
1.- El número de oxidación de un elemento libre (Zn, H2, N2, etc.) es cero
2.- El número de oxidación del hidrogeno es 1 +, excepto en los hidruros metálicos donde es 1-
3.- El número de oxidación del oxígeno es 2-, excepto en los peróxidos que es I-. Con el flúor actúa con número de oxidación 2+
4.- El número de oxidación de los metales en los compuestos es igual a su valencia iónica:
-Alcalinos 1+
-Alcalinotérreos 2+, etc.
5.- El número de oxidación de un ión es igual a su carga
6.- La suma algebraica de los números de oxidación de todos los átomos de un compuesto es igual a cero
Leer más