Estructuras de Lewis para compuestos covalentes – Química 1
Estas estructuras, se utilizan para representar la disposición estructural de los compuestos covalente, auxiliados de los valores de la electronegatividad la estructura de Lewis permiten identificar los diferentes tipos de enlace entre lo átomos que forman al compuesto.
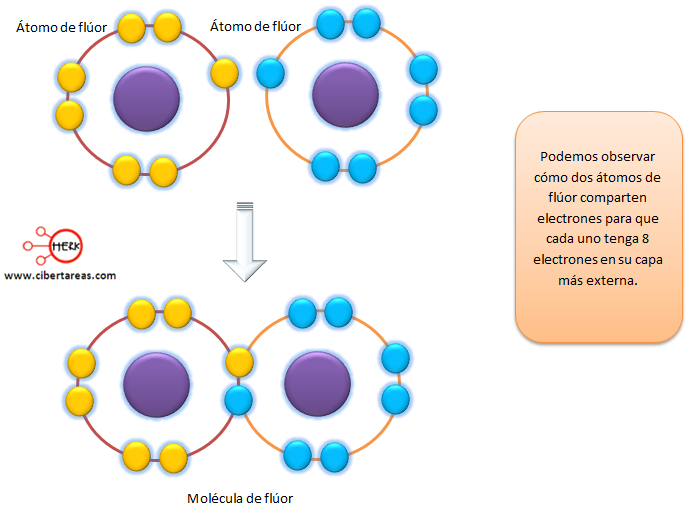
Vamos a observar la siguiente imagen:
Ejemplo:
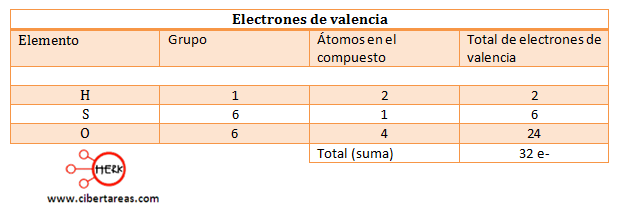
Estructura de Lewis para el ácido sulfúrico (H2SO4)
a) Primero observemos los electrones de valencia:
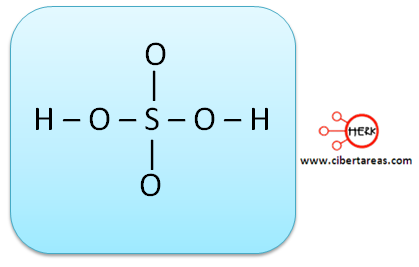
b) Tendríamos esta estructura tentativa:
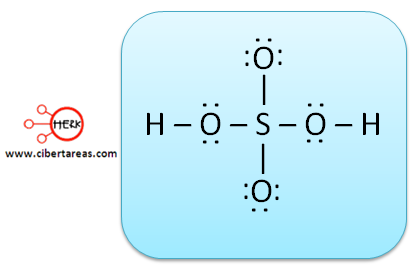
c) Tenemos un total de pases no enlazantes de:
d) Es necesario repartir los diez pares entre los átomos, como sabemos que el hidrogeno no completa el octeto, solo es necesario dos electrones y los tiene con el enlace formado.
e) Todos los átomos exceptuando el hidrógeno, tienen sus ocho electrones, por lo cual se ha llegado a la estructura definitiva, en esta estructura todos los enlaces son covalentes, pero los átomos de oxigeno que están colocados arriba y abajo del átomo central no han compartido ningún electrón, siguen conservando los seis en tres pares de electrones n enlazantes. Para completar el octeto, el azufre ha donado un par de electrones para el enlace, dado esto tenemos el enlace covalente coordinado, para poder diferenciarlo, se coloca una flecha que va del átomo donante al átomo receptor.



santiago rincón cortes says:
me parece muy interesante el tema de la estructura de lewis para los compuestos covalentes ya que nos habla sobre la disposición estructural de los compuestos covalentas, la electronegatividad y los diferentes tipos de enlaces entra los átomos. y también las imágenes ayudan a aclarar mucho mas el tema ya que explican muy bien.
Kevin albeiro burgos gaviria says:
Me parece muy interesante la tabla periodica nos enseña los elementos quimicos de planeta y su inportancia ,su estado fisico peso ,masa ynumero atomico. Y la regla del octeto nos sirve para precedir el conportamiento de las sustancias quimicas.