Ley de las proporciones definidas o de Proust – Química 2
Joseph Louis Proust, químico francés, formulo esta ley y es considerado uno de los padres de la química moderna, la ley nos dice:
Ejemplo
-Metano (CH4)
-Hidrocarburo más sencillo, que se produce naturalmente por la putrefacción anaeróbica de las plantas o por descomposición de materia orgánica en los pantanos
-En la industria se obtiene a partir de la destilación fraccionada del petróleo
-En ambos casos, la composición del metano ya sea “natural” o “sintético” siempre es la misma:
-Un átomo de carbono por curro átomos de hidrógeno, con las mismas características y propiedades.
Composición porcentual
Los investigadores se enfrentan casi a diario con un problema, el cual consiste en determinar la clase y cantidad de elementos químicos que forman parte de una muestra analizada y en qué cantidad lo hacen.
Los resultados del análisis químico se reportan como porcentajes de cada elemento presente en la muestra, en este sentido se habla de composición porcentual
El cálculo de la composición porcentual a partir de la fórmula molecular es muy sencillo:
Ejemplo:
-Determinar la composición porcentual del sulfato de calcio (CaSO4)
Solución:
La masa molar del CaSO4 se calcula:
Masa molar = 136.10 g/mol de CaSO4
La composición porcentual se determina así:
La comprobación se efectúa sumando los porcentajes obtenidos, y el resultado debe ser muy cercano o igual a 100%
Formula mínima
Cando ya se conoce la composición porcentual de un compuesto puede determinarse la fórmula mínima, también denominada fórmula empírica
Para lo anterior se utiliza el siguiente procedimiento: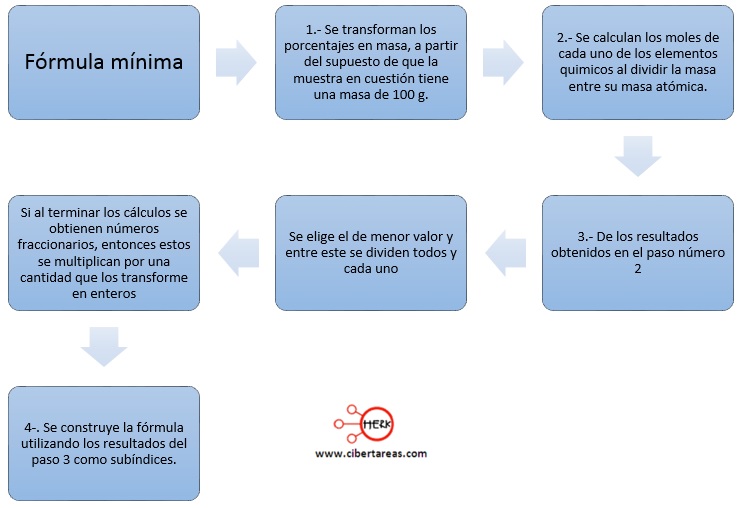
Ejemplo:
-Estricnina
-Es un veneno muy peligroso y se usa como raticida
-Su composición es:
C (75.45%)
H (6.587%)
N (8.383%)
O (9.581%)
-Con estos datos, es necesario encontrar su formula empírica o minima
Solución:
-La muestra tiene una masa de 100 g, con esto los porcentajes se transforman directamente a gramos
-Al seguir los pasos del cuadro anterior, la solución se encuentra de la siguiente manera:
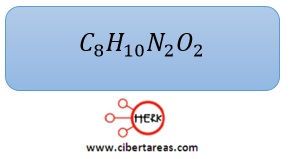
-En una primera aproximación, la formula empírica quedaría así:
-Sin embargo, la formula mínima o empírica requiere que se tengan números esteros para todos los átomos participantes
-Para lograr esto, se multiplican, es este caso, todos los subíndices por 2 y se tiene la solución al problema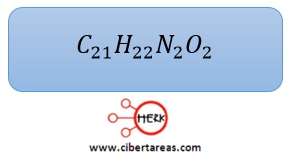

Fórmula molecular
Para obtener esta fórmula, conviene realizar estos pasos: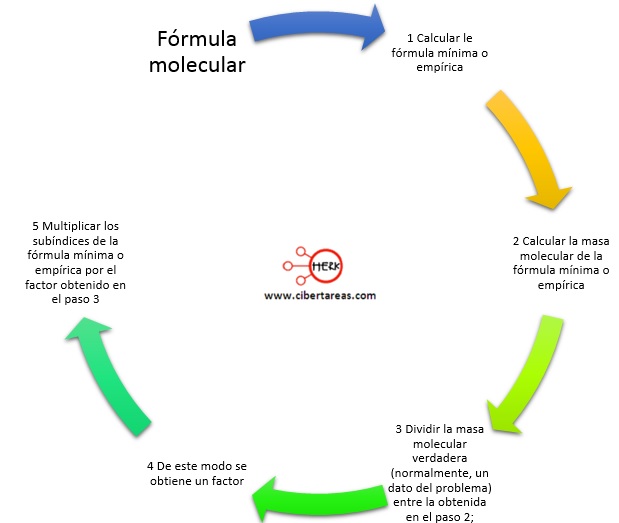
Ejemplo:
-Cafeína
-Está formada por:
-57.8% de C
-6.1% de H
-16.9% de N
-19.3% de O
-Encontrar su fórmula molecular si su masa molar es de 166.166 g/mol
Solución
-Debe aplicarse la secuencia de pasos anterior
1.-Se determina la formula mínima o empírica de la cafeína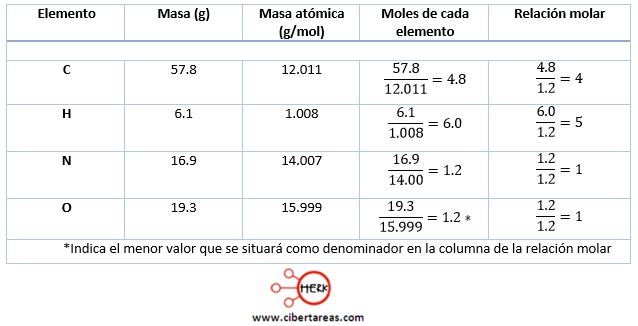
-De esta manera se obtiene la formula mínima o empírica: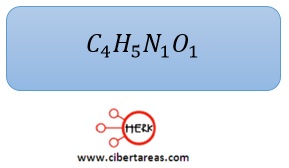
2.- La masa molar de la formula mínima es igual a 83.083
3.- Se divide la masa molar de la formula molecular entre el dato recién calculado para obtener un actor por el que se multiplican los subíndices de la formula mínima
4.- Se multiplican por 2 todos los subíndices, y la formula molecular es: