Lluvia ácida – Química 2
Solía considerarse que el agua de lluvia era la más limpia que podía encontrarse, dado que en el ciclo hidrológico se eliminaban muchos de los contaminantes a través del proceso de evaporación, sin embargo, a partir de la Revolución Industrial esta concepción ha cambiado drásticamente; diferentes industrias y centrales térmicas utilizan combustibles fósiles de baja calidad en sus procesos lo cual envía a la atmósfera cantidades importantes de óxidos de azufre y nitrógeno, afectando la salud y el ecosistema
La lluvia ácida se forma cuando: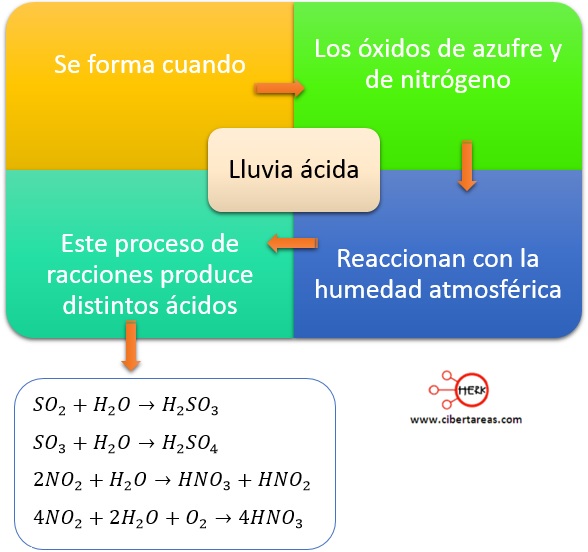
Debemos saber que la lluvia normal es ligeramente acida, debido a que contiene ácido carbónico, que se forma cuando el CO2 del aire se disuelve en el agua que cae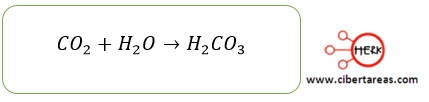
El pH de la lluvia normal suele catar entre 5 y 6, pero en las zonas con la atmósfera contaminada por los óxidos de azufre y nitrógeno, el pH de la lluvia alcanza valores de hasta 3 o 4, y en algunas zonas donde la niebla es ácida, puede llegar a ser de 2 o 3, es decir, similar al del jugo de limón o al del vinagre
Efectos de la lluvia ácida
-Sabe, huele y se siente igual que la lluvia normal y sus efectos nativos sobe la salud no se notan de forma inmediata, sino hasta que llega a las vial respiratorias
-En los bosques, la lluvia ácida no destruye directamente las plantas y los árboles, pero debilita sus funciones biológicas y los hace proclives a las enfermedades, al viento, al hielo y a los parásitos
-Cubre las hojas y así interrumpe el buen proceso fotosintético
-En la construcción provoca reacciones químicas que carcomen las superficies de edificios y monumentos

