Método de óxido-reducción – Química 1
Este método se utiliza:
Es preciso mencionar que el número de oxidación, indica la carga aparente que adquiere un elemento químico cuando forma parte de un compuesto, con esto podemos afirmar que cuando un elemento no forma parte de un compuesto (permanece en estado puro o sin combinar), tiene un numero de oxidación de cero.
Las reglas para determinar el número de oxidación son:
1.- Los elementos que están en estado puto o sin combinar, su número de oxidación es 0, ejemplo:
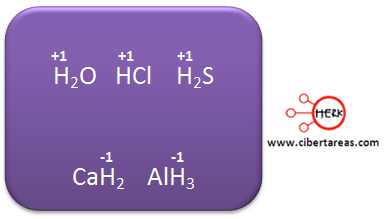
2.- En la mayoría de los compuestos, tenemos que el hidrogeno tiene un número de oxidación de +1, exceptuando los hidruros metálicos, en estos se tiene un numero de oxidación de -1. Ejemplo:
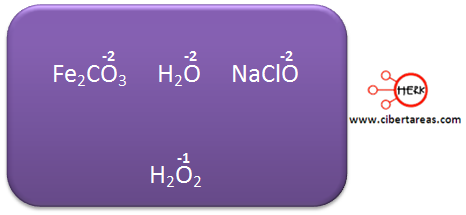
3.- Cuando forma parte de un compuesto, el oxígeno tiene un número de oxidación de -2, exceptuando el caso de los peróxidos en los que trabaja con -1
4.- Los metales de los grupos IA y IIA tienen un número de oxidación positivo igual al número de grupo.
5.- Tenemos que los compuestos son eléctricamente neutros, esta razón hace que la suma de las cargas netas en un compuesto sea igual acero. Existe un caso, los iones poliatómicos, su suma de cargas es igual a la carga del ion, esto es, para poder obtener cargas de cada átomo, se multiplica el subíndice por la carga y se respeta el signo, ejemplo:
Par este caso, el aluminio tiene un número de oxidación de +3, dado que tenemos dos átomos seria:
Tenemos que el azufre tiene un número de oxidación de +6 y un subíndice de 1 (aunque no se escriba)
En el paréntesis tenemos un subíndice de 3, por lo que el total se calcula de la siguiente manera:
Para el oxígeno, se realiza el cálculo de la siguiente manera:
Al momento de sumar:
Esto es correcto ya que es un compuesto.