Mol – Química 2
El estudio de estas relaciones tiene como base el mol, que es:
El mol es definido como la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, electrones u otras partículas) como átomos, hay exactamente en 12 g de carbono 12
A partir de numerosos cálculos y experimentos, los científicos han logrado determinar la cantidad de átomos, moléculas, iones, electrones o partículas presentes en un mol.
Tal cantidad es aproximadamente igual a:
6.0221 x 1023
A este valor se le conoce como número de Avogadro (NA) en honor al físico italiano Amadeo Avogadro, quien lo determinó mediante experimentos con gases
Otra noción de mol indica que cuando se tiene una cantidad de sustancia igual a la masa atómica, (para el caso de un elemento), o a la masa molar, (para el caso de un compuesto), habrá un mol del elemento o del compuesto en cuestión
Esto es, que si se pesan cuidadosamente en la balanza 63.5 g de cobre puro, se tiene un mol de cobre; y si se pesan 18.0 g de agua que es la cantidad igual a su masa molar, se tiene un mol de agua
1 mol de Cu = 63.5 g de Cu
1 mol de H2O = 18.0 g de H2O
Para efectuar los cálculos estequiométricos conviene utilizar el método de factores de conversión, el cual consiste en: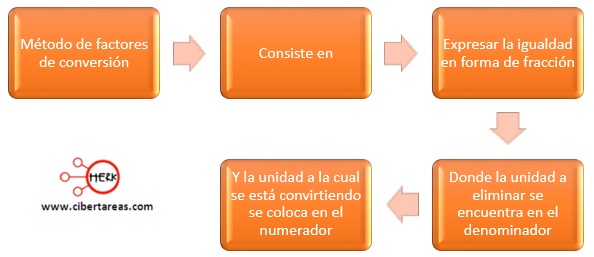
Ejemplo del método de factores de conversión
La primera igualdad se puede escribir de dos maneras
Con lo anterior surge una pregunta: ¿Cómo saber cuál factor de conversión usar para darle la solución a un problema?
Si se requiere convertir masa a moles, se utiliza la expresión:
1 mol de Cu / 63.5 g de Cu
Si se necesita cambiar de moles a masa, se utiliza:
63.5 g Cu / 1 mol de Cu [Ej. 1]
Caso práctico 1
Es necesario calcular la cantidad de moles presentes en las siguientes muestras:
1.- 75 g de hierro (Fe)
Solución
-Consultando la tabla periódica, encontramos que la masa atómica del hierro es igual a 55.84 g/mol
-Como se trata de una conversión de masa a mol, se utilizara un factor de conversión donde aparece el molar la parte superior y la masa en la parte inferior, con lo cual se cancelan los gramos y se obtiene como unidad resultante el mol de hierro
2.- 200 g de sulfato de aluminio (AI2(SO4)3)
Solución
-Se calcula en primera instancia la masa molar del sulfato de aluminio
-Posteriormente, para obtener el total de moles, se usará un factor de conversión con el dato recién calculado: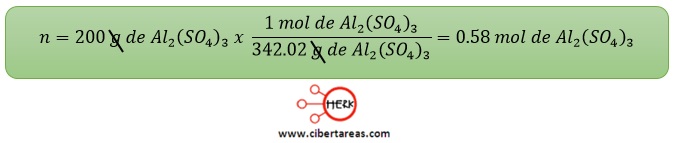
Caso práctico 2
Es necesario calcular la masa de las siguientes muestras:
1.- 0.05 mol de calcio (Ca)
Solución
-El factor de conversión para obtener la solución deberá tener la masa en el numerador y el mol en el denominador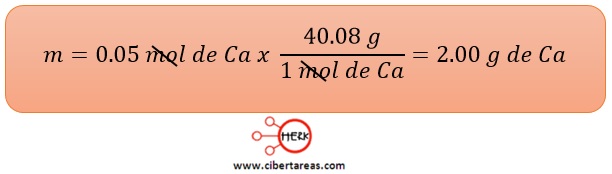
2.- El nitrato de plata (AgNO3) tiene una masa molar de 169.84 g/mol, se calcula de la siguiente manera:
-En consecuencia, la masa de 1.5 mol del compuesto se calcula de la siguiente manera:
Caso práctico 3
Es necesario averiguar el total de partículas (átomos o moléculas) en las siguientes muestras:
1.- 0.005g de zinc (Zn)
Solución
-Es importante identificar se está trabajando con mol o con gramos y si la muestra es de un elemento químico simple o de un compuesto
-Se convierten los gramos de zinc a moles y se multiplican por el número de Avogadro

2.- 1 x 10-3 g de óxido de plomo IV (PbO2)
Solución
-Una vez calculada la masa molar del óxido de plomo IV (PbO2), se convierte la masa a moles y posteriormente se calcula el total de moléculas en la muestra:
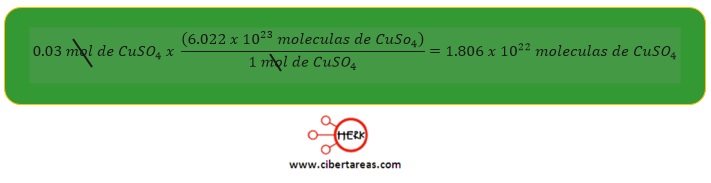
3.- 0.03 mol de sulfato de cobre II (CuSO4)
-Para este caso, ya se conoce el número de moles de la muestra, solamente se necesita multiplicarlo por el número de Avogadro