Las reacciones de oxidación-reducción y su realización en el ambiente, los seres vivos y la industria en Temas selectos de química 2
Al observar el mundo que nos rodea, se puede observar que las reacciones de oxidación-reducción, de óxido-reducción, o redox, como se les suele denominar se desarrollan comúnmente a nuestro alrededor
El estudio de las reacciones de óxido-reducción, ayuda a comprender su importancia y la manera en que el ser humano las utiliza para una gran variedad de aplicaciones, entre las que se encuentra:
-La producción de energía eléctrica, capaz de hacer funcionar una gran cantidad de dispositivos electrónicos
Es importante saber el concepto de reacciones de óxido-reducción, tenemos que:
Debemos considerar que para los compuestos iónicos, las reacciones de oxidación-reducción implican la transferencia de electrones, se dice entonces que:
-El elemento o compuesto que gana electrones sufre una reducción
-Elemento o compuesto que pierde electrones, sufre una oxidación
Como ejemplo podemos observar la siguiente reacción:
-Sodio metálico
-Reacciona con cloro gaseoso para formar cloruro de sodio, un compuesto iónico
Durante el proceso:
-El átomo de sodio cede un electrón al átomo de cloro
-El sodio se ha oxidado y el cloro, reducido
Hay que considerar que es frecuente que las reacciones redox se estudien considerando por separado los procesos de oxidación y de reducción
Cuando esto se aplica, a cada una de las expresiones se les denomina:
-Semiecuaciones o medias ecuaciones
Las cantidades de electrones ganado y perdidos en una reacción química deben ser iguales, ya que no pueden crearse ni destruirse electrones en el proceso, de acuerdo a la ley de la conservación de la masa
Por esta razón, los dos electrones cedidos por el sodio son exactamente los mismo dos que captan los átomos de cloro
Como ejemplo de reacciones de oxidación-reducción en el cual se forma un compuesto iónico es:
Fenómeno de oxidación-reducción en los compuestos covalentes
Es importante saber cómo se efectúa el fenómeno de oxidación-reducción en los compuestos covalentes, esto es:
-En los compuestos covalentes no se da una cesión de electrones de un átomo a otro, sino que son compartidos entre ellos
Si los átomos son de la misma electronegatividad (enlace covalente no polar), el par de electrones de enlace se sitúa exactamente entre ellos y la nube electrónica adopta una forma perfectamente regular, sin que exista una acumulación de cargas en algún extremo de la molécula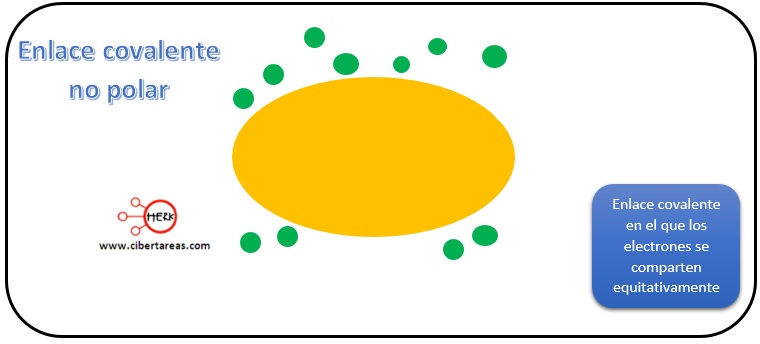
Consideremos que si la electronegatividad de los átomos participantes es diferente (enlace covalente polar), se formarán cargas parciales o dipolos (δ) que indican hacia dónde se desplaza la nube electrónica
El dipolo negativo (δ–) se establece en el extremo de la molécula donde se ubica el átomo más electronegativo porque los electrones de enlace están más cerca de él
Cuando se produce una reacción redox en la que participan moléculas covalentes no hay una transferencia de electrones, sino más bien una transferencia de densidad electrónica, la cual está en función de la diferencia de electronegatividad de los átomos participantes en el enlace
Por ejemplo:
-Cuando reacciona una molécula de hidrógeno gaseoso (H2) con otra de bromo (Br2) para formar bromuro de hidrógeno:
Los reactivos poseen enlaces covalentes no polares y el par electrónico de enlace está repartido equitativamente
Sin embargo, en el producto de la reacción la densidad electrónica se desplaza hacia el bromo, que es más electronegativo que el hidrógeno, y se forman entonces dipolos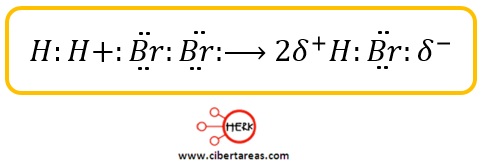
Como en realidad no hay transferencia neta de electrones e a participantes, para describir este tipo de reacciones redox un concepto denominado número de oxidación.



YUDITH says:
me encanta
YUDITH says:
me gusta me encanta