Numero cuántico n Niels Bohr – Química 1
Niel Bohr, para realizar sus experimentos se basó en el modelo de Rutherford y la teoría cuántica de Max Planck, para poder dar una explicación a los espectros de emisión durante su trabajo con el hidrogeno y planteó lo siguiente:
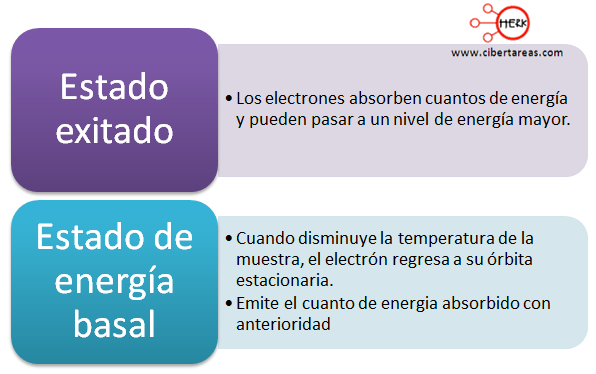
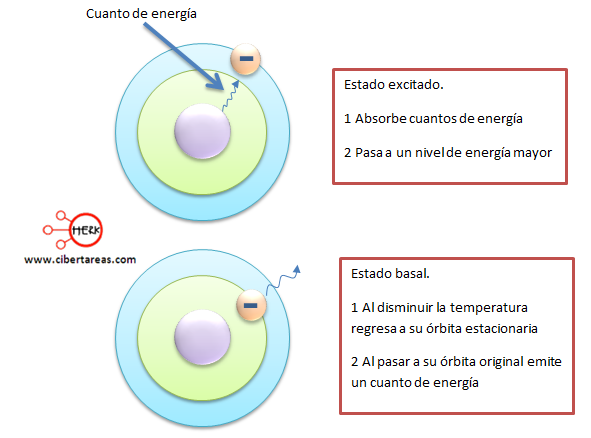
Bohr planteo la existencia de niveles energéticos donde el electrón se encontraba, los cuales solo pueden tener cierta cantidad específica de energía cuantizada.
Al calentarse una muestra de algún elemento químico debemos considerar:
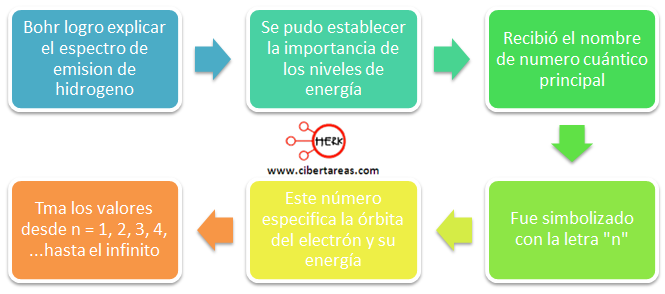
Con esta teoría, se logró explicar el espectro de emisión de hidrogeno y se pudo establecer la importancia de los niveles de energía que posteriormente recibió el nombre de numero cuántico principal y fue simbolizado con la letra n.
Con sus estudios de gases nobles, Bohr propuso que en cada nivel de energía podía estar un número limitado de electrones.
A partir del modelo propuesto por Bohr, fue posible deducir los valores para los radios de las orbitas y para sus energías.
El mejoramiento de las técnicas espectográficas permitieron obtener resultados con mayor grado de resolución, esto demostró que en los espectros de emisión las rayas que eran consideradas como simples, aparecieran como dos o más líneas que deberían corresponder a energías semejantes.
Esto quiere decir que el electrón puede tener varios estados que poseen igual energía en ausencia de un campo magnético, pero diferente energía en su presencia.