Ácidos polipróticos en Temas Selectos de Química 2
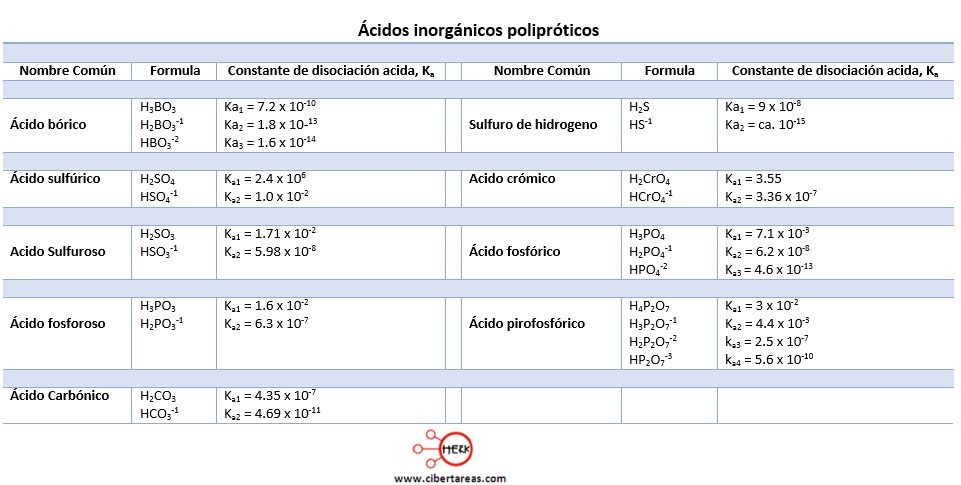
Estos ácidos con capaces de disociarse en etapas sucesivas y para cada una de ellas se calcula una constante de disociación acida (Ka1, Ka2, Ka3, etc.)
Esto se puede observar en el caso de la disociación del ácido sulfúrico:
Para la primera disociación, el valor de Ka es muy alto, por lo que se infiere que casi todo el reactivo original se disocia en iones hidrogeno e hidrógenosulfato, hecho que se indica mediante la flecha en un solo sentido
Sin embargo en la segunda disociación, debido a que el valor de Ka es mínimo en comparación con el anterior, se entiende que habrá unos pocos iones hidrogeno y sulfato derivados de este proceso
Para los efectos prácticos, cuando debe calcularse la disociación de una ácido poliprótico, debido a su magnitud basta con tomar en cuanta Ka1
Los valores de la constante para las dos disociaciones muestran un hecho que es de carácter general para los ácidos polipróticos, esto es:
-Es más sencillo arrancar el primer protón que el segundo y, a su vez, es más sencillo despojar al acido del segundo protón que del tercero
En el siguiente cuadro se expresan algunos calores para la disociación en etapas sucesivas para ácidos inorgánicos polipróticos y las cifras muestran lo que se comentó en el punto anterior: