Concentración de iones hidronio y pH – Química 2
Es importante conocer que en el agua pura sucede un fenómeno muy interesante:
-Aunque no contenga ningún electrolito disuelto, ella misma se comporta como un electrolito muy débil y puede ionizarse
Esto es, dos moléculas de agua interaccionan entre sí y producen un ion hidronio y un ion hidroxilo por transferencia de un protón de una molécula de agua a la otra:
En el agua pura, las concentraciones de los iones hidronio e hidroxilo son iguales:
Por lo que se considera como una sustancia neutra
En el agua pura la concentración de ambos iones es de 1 x 10-7, valor que se calcula a partir de la constante de ionización del agua
En medio ácido, la concentración de iones hidronio es mayor que la de iones de hidroxilo: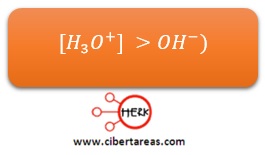
En medio básico, ocurre lo contrario:
Los ácidos y las bases se comportan como sustancias antagónicas ya que al reaccionar entre sí se neutralizan obteniéndose como productos una sal y agua
Al hacer reaccionar al ácido sulfúrico, que es un compuesto muy corrosivo, con hidróxido de sodio que es fuertemente cáustico, ambas sustancias se contrarrestan formando agua y sulfato de sodio, una sal incolora y cristalina que ya no muestra las propiedades del ácido o de la base que le dieron origen: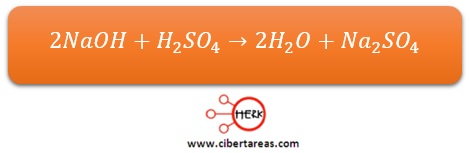
Por ejemplo, una reacción de neutralización de uso muy común es la que se desarrolla en nuestro estómago cuando se ingiere un antiácido para aliviar la acidez estomacal
Esto es, el antiácido es una base débil cuyo efecto consiste en elevar el pH del medio estomacal al neutralizar una buena parte del ácido gástrico (HCl) que ahí se produce


