Grados de acidez o de basicidad de la solución – Química 2
Debemos conocer que la acidez o la alcalinidad de una sustancia están en función de la concentración de iones hidronio que se obtiene al disolverla en agua
En la mayoría de las sustancias naturales comunes, estas concentraciones son muy bajas; por esta razón el poder expresarlas en forma decimal o exponencial resulta complejo, y con frecuencia es fuente de errores
Sören Sörensen, químico danés, propuso una alternativa para expresar la concentración de H3O+, propuso: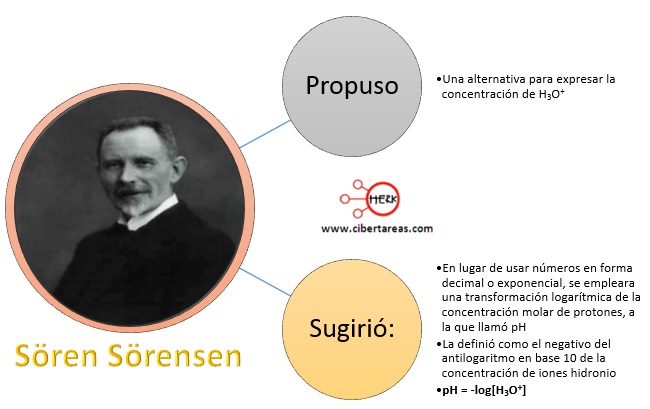
Dada su analogía, el pOH se describe como el negativo del antilogaritmo en base 10 de la concentración de iones hidroxilo:
El producto de las concentraciones de iones hidronio e iones hidroxilo es siempre igual a 1 x 10-14 por lo que al utilizar las propiedades de los logaritmos se puede escribir:
Debemos saber que al incrementarse la concentración de iones hidronio, la de iones hidroxilo deberá disminuir para que la suma, al final, siga siendo 14, sucediendo lo mismo a la inversa
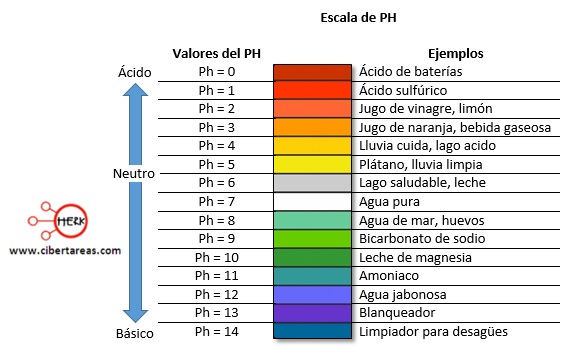
En química se emplea el pH para determinar de forma precisa la acidez o basicidad de una sustancia
Normalmente oscila entre los valores de:
-Mas acido (0)
-Mas basico (14)
A partir de la concentración de iones hidronio se puede determinar el pH de una disolución
Ejemplos
Caso 1
-Es necesario calcular el pH de una disolución de fenol, C6H5OH
-Su concentración de iones hidronio [H3O+] = 1.8 x 10-5 M
Solución
Se considera la definición pH = -log[H3O+] y de acuerdo a los datos, tenemos [H3O+] = 1.8 x 10-5 M
Tomando el logaritmo negativo para ambos miembros de la igualdad y resolviendo con la ayuda de una calculadora, tenemos:
El resultado que arroja del pH, indicia que la solución es ácida
Caso 2
-Para una cierta disolución de ha calculado que la concentración de iones hidroxilo es 2 x 10-6 M
-Es necesario calcular el pH de la disolución
Solución
Debemos considerar a la constante de disociación del agua, [H3O+][OH–] = 1 x 10-14, por lo que al sustituir, despejar y resolver se tiene:
Con el resultado podemos decir que la solución es ligeramente básica