Enlace iónico –Química 1
A manera de introducción, tenemos que un enlace es la unión de dos o más elementos y el ión es un átomo o grupo de átomos que presenta una carga de electrones positiva o negativa.
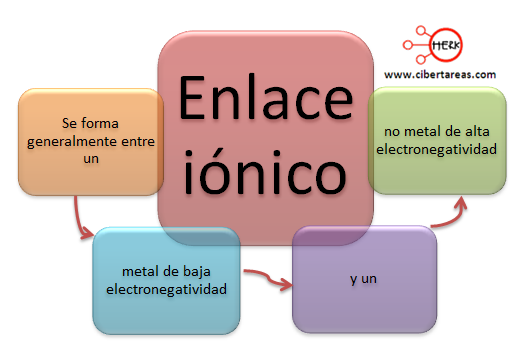
Entonces tenemos que un enlace iónico es:
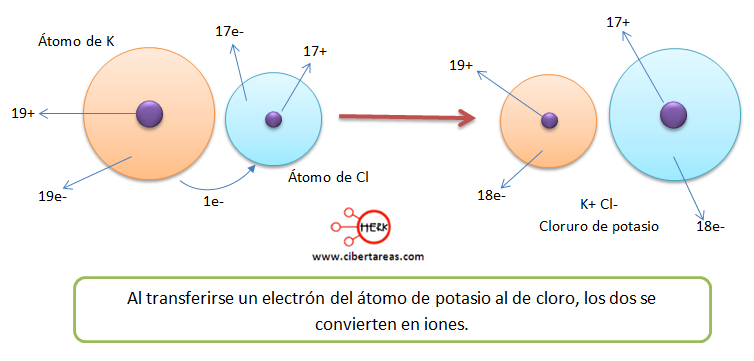
Tenemos que en el mecanismo de reacción, el átomo del elemento no metal literalmente arranca los electrones de la capa de valencia del átomo del elemento metálico, y con esto se convierte en un anión, y el metal se transforma en un ión positivo (catión) al momento de perder los electrones. LA atracción entre iones de cargas opuestas da origen a la formación de los enlaces.
Los elementos metales, como tienen pocos electrones en su capa de valencia, tiende a reaccionar con los no metales, esto es, pierden electrones y se convierten en cationes, está perdida de electrones influye en el volumen atómico.
Observemos la siguiente imagen:
Podemos ver que los átomos de sodio son más grandes que los iones del sodio.
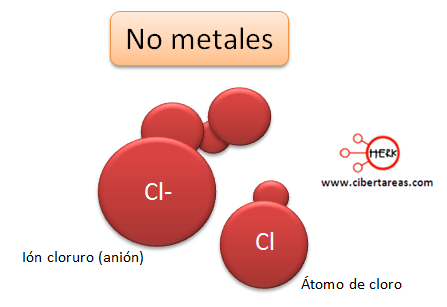
Mientras tanto los no metales poseen más electrones en su capa de valencia y estos elementos tienden a adquirir electrones, por lo que frecuentemente aparecen como aniones, el volumen de los aniones es mayor que el de los átomos de los no metales.
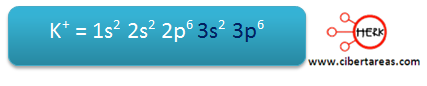
Tenemos que señalar que esto trae como resultado que ambos iones adquieran una capa exterior con 8 electrones:
Tenemos 1 electrón en la capa de valencia:
Ahora se tienen 7 electrones en la capa de valencia:
Una vez que se da el intercambio electrónico, tenemos 8 electrones en la última capa:
Y de igual manera también se tienen 8 electrones en la última capa:
Ejemplo:
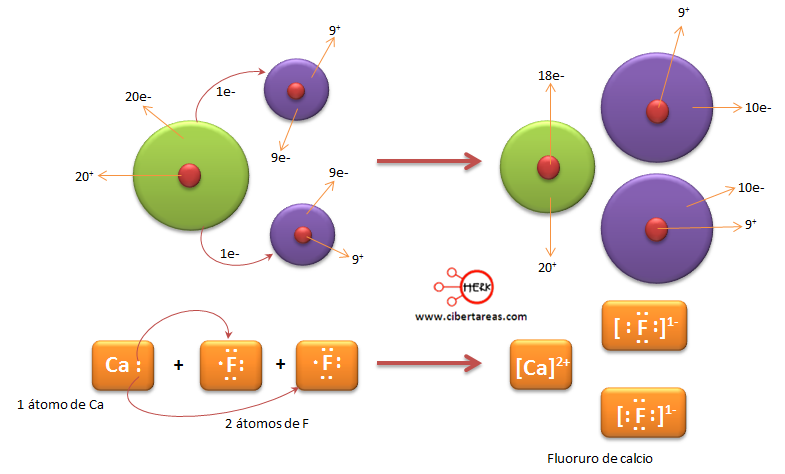
Combinación del flúor y calcio para formar fluoruro de calcio (CaF2)
Tenemos que un átomo de calcio posee la siguiente estructura electrónica:
Y para poder obtener la configuración del gas noble argón debe perder esos dos electrones:
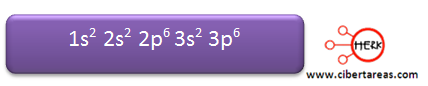
Mientras que el flúor tiene la siguiente configuración electrónica:
Y para poder alcanzar la configuración estable del gas neón es necesario que gane un electrón.
Para que se forme el fluoruro de calcio, por cada átomo de calcio que cede dos electrones es necesario que dos átomos de flúor los capten, cuando esto sucede el átomo del calcio se transforma en el ión calcio (Ca2+) y tenemos que los átomos del flúor deben transformarse en iones fluoruro (F).
Como sabemos, la electronegatividad, la cual es una medida de fuerza con la que un átomo atrae hacia sí mismo los electrones de enlace, esto es de suma importancia en la formación del enlace iónico.
Es importante destacar que para que la transferencia pueda llevarse a cabo, se necesita una diferencia de electronegatividad mayor a 2.0 entre los átomos que forman el enlace.
Ejemplo:
Fluoruro de calcio (CaF2)
El flúor posee un valor de electronegatividad de 4.0 pauling.
El calcio posee un valor de electronegatividad de 1.0 pauling.
Al realizar el cálculo, la diferencia entre los dos elementos es de 3.0, por lo se denota que efectivamente se trata de un compuestos iónico.