Factores que modifican la velocidad de reacción – Química 1
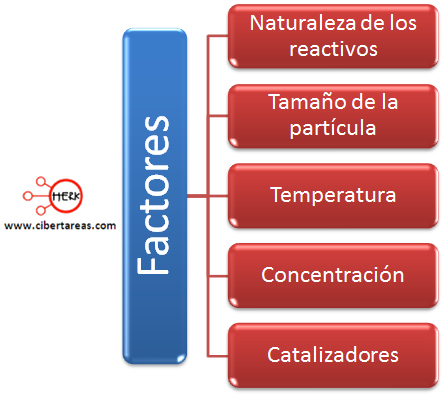
Las reacciones químicas son afectadas en su velocidad por varios factores como:
Naturaleza de los reactivos
Las reacciones químicas se ven favorecidas cuando:
Muchos de los procesos químicos se llevan a cabo entre reactivos en diferente fase (gas con solido), en estos casos la reacción se lleva a cabo en interfase, esto quiere decir que se lleva a cabo en la superficie de contacto entre ambos reactivos. En estos casos, si la superficie de contacto es pequeña, la velocidad de reacción es pequeña y si la superficie de contacto es grande, favorece la reacción y por consecuencia se incrementa la velocidad.
Tamaño de la partícula
Cuando los reactivos se encuentran en diferente fase, existe un forma de incrementar su velocidad de reacción esta consiste en:
Temperatura
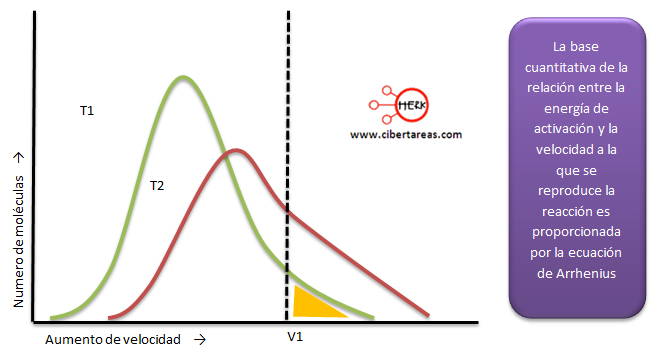
Cabe mencionar que la temperatura es una medida de la energía cinética la cual esta asociada al movimiento de las partículas que componen el sistema calorífico. Como sabemos, las moléculas de cualquier compuesto tienen cierto movimiento:
-En los sólidos, es reducido.
-En los líquidos, aumenta un poco.
-En los gases, es mucho mayor.
A manera de conclusión podemos decir que a medida que aumenta o disminuye la temperatura, el movimiento molecular aumenta o disminuye de manera proporcional.
Entonces se pude afirmar que la velocidad de reacción se incrementa con el aumento de la temperatura.
Se ha determinado que por cada 10°C de incremento en la temperatura de reacción, se tiene que la velocidad casi se duplica o se triplica, aunque este incremento de temperatura depende de la naturaleza de los reactivos.
Concentración
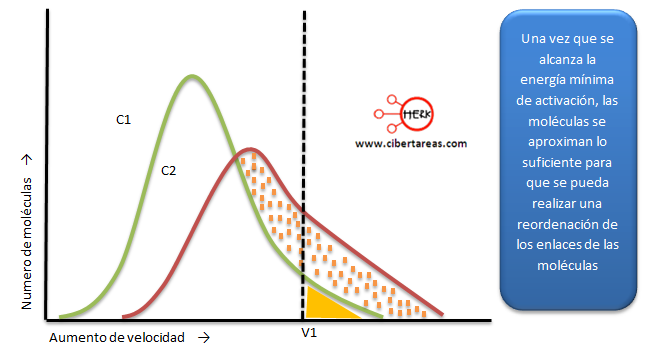
Dentro de una reacción química, sucede que al aumentar la concentración de uno de los reactivos, se multiplica la velocidad de reacción, veamos:
Para saber en qué medida se multiplica la velocidad de reacción, se debe determinar de una manera cuantitativa la forma en que la concentración de los reactivos influye en la velocidad de formación de los productos, en necesario aplicar la ley de acción de masas (C.M. Guldberg, P. Waage).
Ejemplo:
Suponiendo que se lleva a cabo la siguiente reacción hipotética:
Para poder calcular la velocidad de reacción es necesario utilizar la siguiente expresión matemática:
Dónde:
Observemos que la concentración del reactivo B no tiene exponente ya que en la ecuación original tiene coeficiente 1, tenemos que precisar que tanto el valor de la constante k como los exponentes de las concentraciones se determinan experimentalmente, lo cual implica que pueden tomar valores positivos, negativos o cero, esto dependiendo de las condiciones de la reacción y de los valores de la concentración.
Catalizadores
Los catalizadores se describen como:
Entonces tenemos que un catalizador puede recuperarse prácticamente intacto al término de la reacción.
Ejemplo:
Al momento de la descomposición del clorato de potasio para la producción de oxígeno y cloruro de potasio, solo se añade una cantidad de calor determinado, pero cuando se utiliza dióxido de manganeso (MnO2) para catalizar la reacción, ésta se desarrolla con mucha mayor rapidez, en condiciones controladas y con un menor gasto de energía.
Para identificar la presencia del catalizador, se escribe la formula sobre la flecha de reacción, pero no se debe de tomar en cuenta para el balanceo de la ecuación ni para establecer la formación de compuestos, ejemplo:
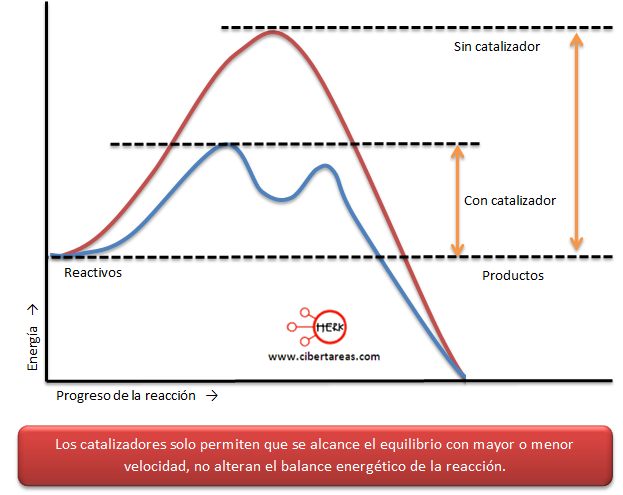
Se ha logrado establecer que los catalizadores no solamente acelera la reacción sino que ayuda a que la reacción se lleva a cabo por otro camino más sencillo y con menor gasto de energía.










Oscar Flores says:
Increíble, exactamente lo que estaba buscando para estudiar sobre mi practica de laboratorio, muchas gracias.