La escala de pH en Temas selectos de Química 2
Para el año de 1909, el químico danés Sören Sörensen propuso una alternativa para expresar la concentración de H3O+, Sörensen propuso:
Por analogía, el pOH se describe como el negativo del logaritmo en base 10 de la concentración de iones hidroxilo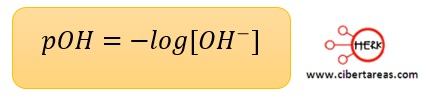
De acuerdo con la constante de disociación del agua, el producto de las concentraciones de iones hidronio e iones hidroxilo, como se ha observado, es siempre igual a 1 x 10-14, por lo que al utilizar las propiedades de los logaritmos se puede escribir:
En la expresión anterior, se puede observar con mayor claridad que al aumentar la concentración de iones hidronio, la de iones hidroxilo deberá disminuir ara que la suma, al final, se mantenga igual a 14 y viceversa
En el siguiente cuadro se pude ver las concentraciones molares de iones hidronio e hidroxilo y su expresión correspondiente de pH o pOH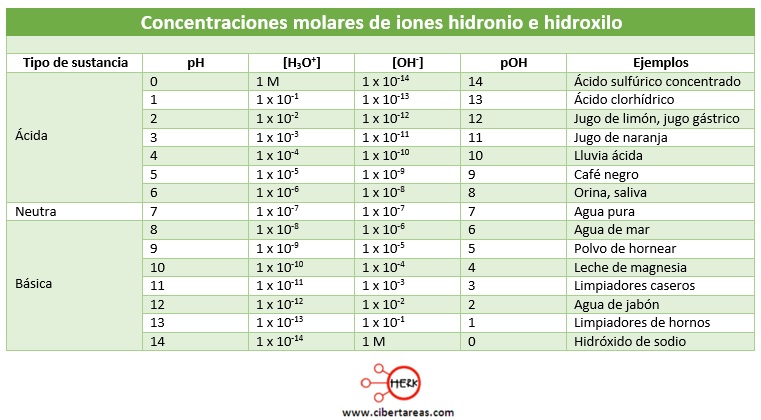
De los datos de la tabla, se pueden derivar algunas propiedades importantes del pH:
-El pH varía inversamente a la concentración de iones hidronio, lo cual quiere decir que mientras más bajo sea al valor del pH, mayor será la concentración de H+ y por tanto, también será mayor la acidez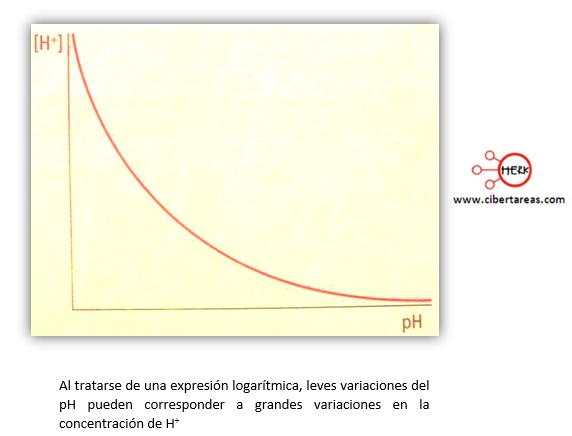
-Ya que la escala de pH es logarítmica, el cambio de una sola unidad representa, en realidad, una variación de diez veces la concentración de H+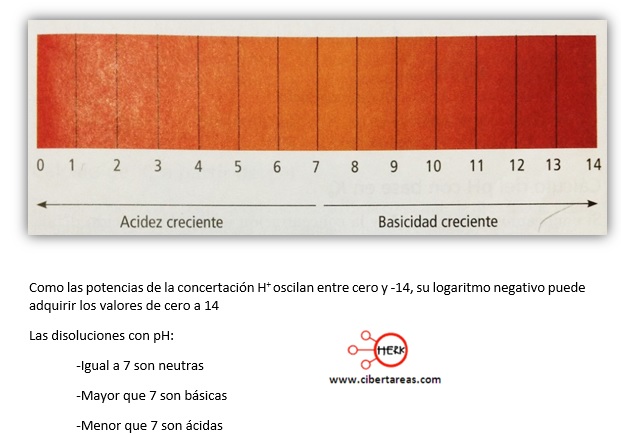
Es importante revisar la forma en que a partir de la concentración de iones hidronio, se determina el pH de una disolución
Ejemplo 1
-Es necesario determinar el pH de una disolución de fenol
-C6H5OH
-Cuya concentración de iones hidronio [H3O+] es de:
-1.8 x 10-5 M
Solución
-Se considera la definición de pH:
-pH = -log[H3O+]
-De acuerdo con los datos del problemas [H3O+] = 1.8 x 10-5
-Se toma el logaritmo negativo para ambos miembros de la igualdad y se resuelve con la ayuda de una calculadora, y tenemos: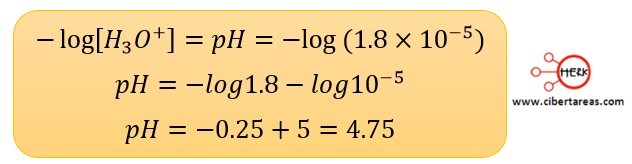
-Este valor de pH indica que la disolución es ácida
Ejemplo 2
-Para cierta disolución se ha calculado que la concentración de iones hidroxilo es 2 x 10-6 M
-Es necesario calcular el pH de la disolución
Solución
-Se necesita recordar que de acuerdo a la constante de disociación del agua:
-[H3O+][OH–] = x 10-14
-Sustituyendo, despejando y resolviendo tenemos:


