Calculo del pH con base en Ka en Temas selectos de química 2
Si se conoce el calor de Ka y la concentración inicial de un ácido débil, puede calcularse la concentración de iones hidrogeno [H+] en una disolución de un ácido débil
En el siguiente ejemplo se ejemplifica el cálculo para lo anterior:
Ejemplo:
-Para el ácido benzoico (HC7H5O2) el valor de Ka es igual a 6.3 x 10-5
-Es necesario saber cuál será la concentración en equilibrio de [H3O+] y el pH de la disolución si la concentración inicial del ácido benzoico es 0.050 M
Solución:
Se escribe la ecuación para la disolución del ácido benzoico y a partir de ella, se anota la expresión para la constante de disociación ácida como sigue:
Al efectuar el análisis del proceso de disociación y los cambios de concentración que se derivan, tenemos: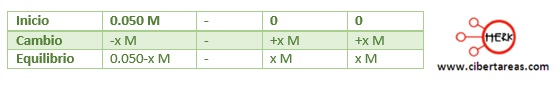
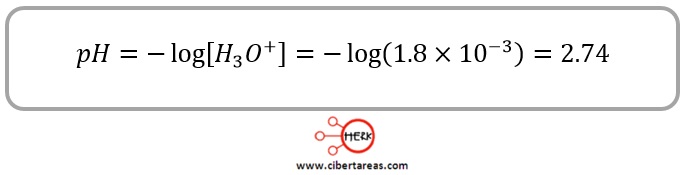
De acuerdo con la definición de pH, se toma el logaritmo negativo de la concentración de iones hidronio que se calculó, esto para obtener el pH de la disolución: