Línea de tiempo de la clasificación de los elementos químicos – Química 1
La primera clasificación echa en el siglo XIX
Triadas de Döbereiner (1817)
En 1817, el químico Johan Döbereiner elaboro un reporte en el que se mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades.
En este reporte se mencionaba la existencia de similitudes entre elementos, los cuales se agruparon en tríos que se le denominaron “triadas”
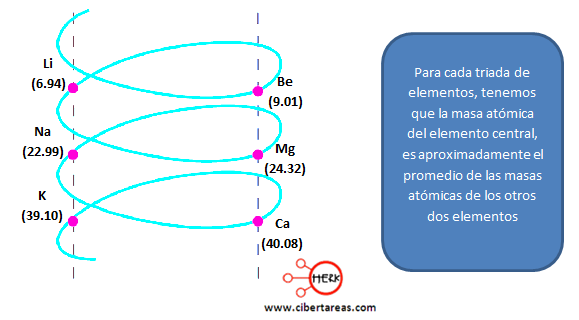
Ejemplo:
En cada triada de elementos, la masa atómica del elemento central es, aproximadamente, el promedio de las masas atómicas de los otros dos elementos.
Con esto se llegaron a conocer aproximadamente unas veinte triadas, así se llegó a una primera clasificación de los elementos.
Octavas de Chancourtois y Newlands (1862)
El geólogo francés Alexander Beguyer de Chancourtois, propone que existe cierta periodicidad entre los elementos de la tabla, con ayuda del químico inglés John A. Newlands, proponen la ley de las octavas, en esta:
Sin embargo esta clasificación pronto fue desechada por la comunidad científica.
Meyer y Mendeleïev (1869)
Julios L. Meyer, químico alemán, se da cuenta que entre los elementos existe cierta periodicidad en el volumen atómico.
Por ejemplo, los metales alcalinos tienen un volumen atómico mayor, para representar esto, Meyer realizo la siguiente gráfica:
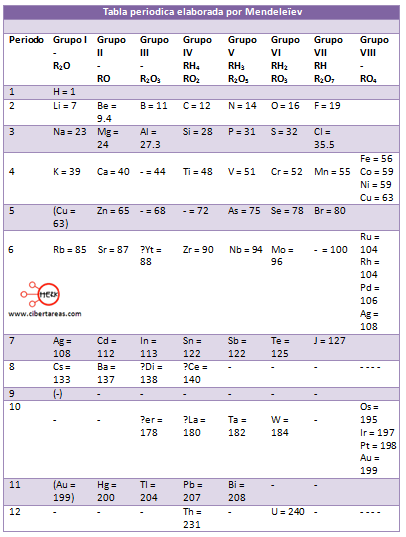
Este mismo año (1986) Dimitri Mendeleïev, quimico ruso, presenta la primera version de una tabla periodica, se considero como la primera tabla coherente de las semejanzas de los elementos quimicos, ya que contenia los 63 elementos conocidos hasta esos años, esta tabla tomanba la masa atomica como el criterio principal de ordenamiento.
Esta tabla de los elementos se diseño de manera que su pudiera observar la periodicidad de los elementos, clasificandolos verticalmete, tenemos que las agrupaciones horizontales se suceden representado los elementos de la misma familia.
Moseley y el numero atomico
El quimico-fisico Henry Moseley, realizo experimentos sofisticados para su epoca en los cuales logro:
Los resultados que obtuvo permitieron encontrar una relación sistemática entre la longitud de onda de cada elemento y su número atómico (Z).
Este descubrimiento arrojo resultados muy importantes ya que antes de estos experimentos, el número atómico era solo mencionado pero no se había podido comprobar medir.








Yord says:
buena información, gracias