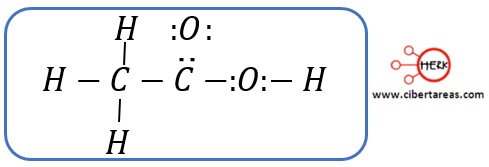El número de oxidación en Temas Selectos de Química 2
El número de oxidación se puede definir como: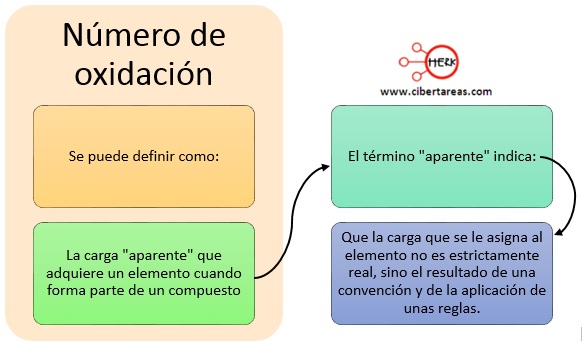
Un método para asignar el número de oxidación consiste en:
-Utilizar las estructuras de Lewis
-En la cual los electrones enlazantes se asignan al átomo más electronegativo y se aplica la fórmula siguiente: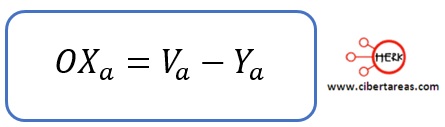
-Se indica en primera instancia, la estructura de Lewis y se le asigna los electrones de enlace al átomo más electronegativo (el bromo), el cual se indica colocándolos más cerca de él: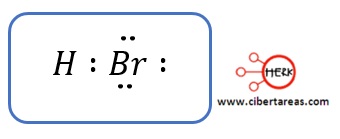
-El átomo de bromo posee 7 electrones de valencia y de acuerdo a la estructura de Lewis se le han asignado en total 8 electrones, por lo que aplicando la fórmula se tiene:
-El hidrógeno posee 1 electrón de valencia y como no le ha tocado electrón en la estructura de Lewis, se tiene: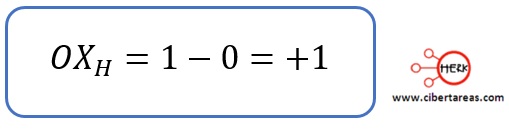
-Ahora se puede escribir la fórmula como si fuese un compuesto iónico e indicar los números de oxidación:
Analizando el ejemplo anterior, es fácil determinar cuál de los dos elementos se ha oxidado y cuál se ha reducido, ya que no hay que olvidarse que en la reducción, como su nombre lo indica, el número de oxidación disminuye, que es lo que sucede para el bromo, que pasa de 0 a 1-
El hidrógeno se ha oxidado y su número de oxidación crece de 0 a 1+
Este método es de mucha utilidad cuando se aplica a los compuestos orgánicos
Ejemplo
-Se le asigna los electrones al átomo más electronegativo: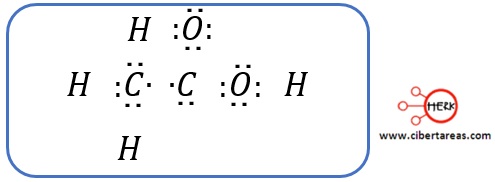
-Con lo anterior ya se puede calcular el número de oxidación para cada uno de carbonos:
-Tenemos que para los átomos de oxígeno (en ambos casos):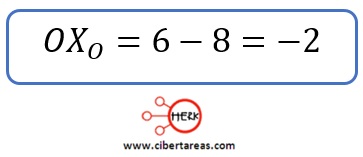
-Y para cada uno de los átomos de hidrogeno: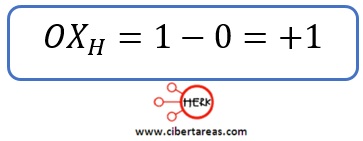
-Con esto, la representación del ácido acético con sus números de oxigeno es: