Relaciones estequiométricas y la ley de la conservación de la masa – Química 2
Existen tres tipos de relaciones estequiométricas en las que se aplica directamente la ley de la conservación de la masa: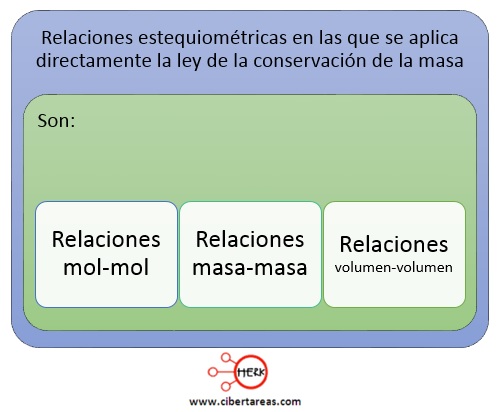
Relaciones mol-mol
-Proporcionan los moles que se obtienes de una sustancia a partir de los moles de otra según la ecuación química balanceada
Ejemplo:
-Sulfato de sodio Na2SO4
–Compuesto que se utiliza en algunas etapas del proceso de fabricación del papel
–Sirve para obtener compuestos resistentes al fuego
-Se pude producir por la reacción entre el ácido sulfúrico (H2SO4) y el hidróxido de sodio (NaOH)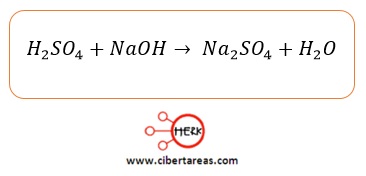
Problemática:
Si se suministra a la reacción 4 moles de NaOH, ¿Cuántos moles de Na2SO4 se obtendrán?
Solución:
-La ecuación química debe cumplir con la ley de la conservación de la masa, es decir, debe estar balanceada, por lo cual se colocan los coeficientes necesarios: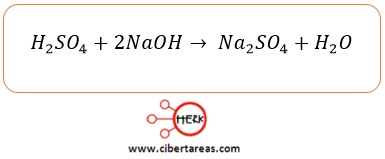
Los coeficientes de una ecuación balanceada representan los moles de cada una de las sustancias participantes
En este ejemplo se tiene que:
-1 mol de H2SO4 reacciona con 2 moles de NaOH para producir 1 mol de Na2SO4 y 2 moles de H2O
De acuerdo con esto, la relación de moles de NaOH y Na2SO4 se puede expresar de la siguiente manera:
-1 mol de Na2SO4 se obtiene a partir de 2 moles de NaOH
Para resolver este problema conviene expresar la relación anterior de la siguiente manera:
Al utilizar el dato del problema, la solución se escribe así:
Relaciones masa-masa.
-A partir de la masa de una sustancia se calcula la masa de un reactivo o de un producto
Ejemplo:
-Hipoclorito de sodio NaCIO
–Ingrediente activo de muchos blanqueadores comerciales
-Puede obtenerse mediante la reacción controlada entre el hidróxido de sodio y el cloro elemental: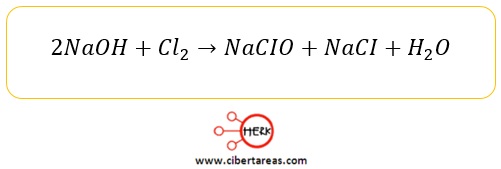
Problemática:
-De acuerdo con la reacción, ¿Cuántos gramos de NaOH son necesarios para obtener 500 g de NaCIO?
Solución:
-Se aplica la siguiente estrategia:
a) Convertir los gramos de NaCIO a moles utilizando su masa polar b) Establecer la relación de moles a partir de la ecuación balanceada y calcular los moles de NaOH
b) Establecer la relación de moles a partir de la ecuación balanceada y calcular los moles de NaOH c) Por último, cambiar los moles de NaOH a gramos utilizando su masa molecular, con lo cual se obtiene el resultado
c) Por último, cambiar los moles de NaOH a gramos utilizando su masa molecular, con lo cual se obtiene el resultado

Es importante observar que el proceso requiere convertir gramos amoles, establecer la relación molecular y cambiar de moles a gramos
El resultado se obtiene multiplicando todas las cantidades que se encuentran en los numeradores y dividiendo posteriormente este resultado entre el producto de todos los denominadores
Relaciones volumen-volumen
-A partir del volumen de una sustancia se determina el volumen de otra
-Se toman en cuenta las condiciones de presión y temperatura en las que se desarrolla la reacción
Ejemplo:
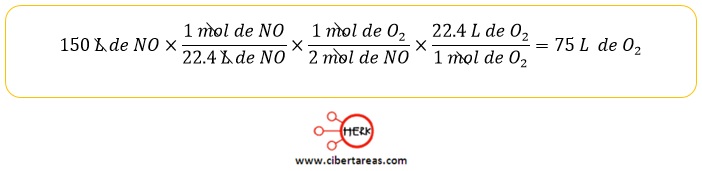
-La reacción entre el monóxido de nitrógeno (NO) y el oxígeno (O) da como resultado la formación de dióxido de nitrógeno (NO2), sustancia que participa para la producción del esmog fotoquímico
Problemática:
-Si la relación se desarrolla en condiciones estándar de temperatura y presión, ¿Cuántos litros de oxigeno se necesitan para reaccionar con 150 L de monóxido de nitrógeno?
Solución:
-En las condiciones estándar de temperatura y presión (T= 0°C y 1 atm), un mol de cualquier gas ocupa un volumen de 22.4 L
-Al tomar como punto de partida esta información, se procede con la siguiente estrategia:
a) Convertir los litros de NO a moles
b) Establecer la relación molar que proporciona la ecuación balanceada