Indicadores ácido-base en Temas Selectos de Química 2
Para medir el pH de una sustancia existen dos métodos:
Para los dos casos se tiene una disolución “patrón” de pH conocido y a partir de ella se compara el de la sustancia problema
Método colorimétrico
En este método se emplean ácidos y bases orgánicas débiles, cuyas moléculas tienen un color cuando están en medio básico y otro en medio ácido
Para ser mas precisó, los indicadores adquieren un color cuando están disociados y otro cuando no lo están, debido principalmente a que están formados por sistemas resonantes aromáticos (los aromáticos son compuestos derivados del benceno), que pueden modificar la distribución de carga según la forma que adopten
Lo anterior provoca que la absorción energética se modifique y con ello el color que presenta el indicador
Entonces tenemos que cuando se trata de determinar el pH, se suministran a la sustancia problemas unas gotas del indicador y de acuerdo a la coloración se determina su acidez o basicidad
¿Cómo funciona un indicador?
-Para entenderlo, se puede establecer un equilibrio de disociación para un indicador ácido, que se denotan por HIn: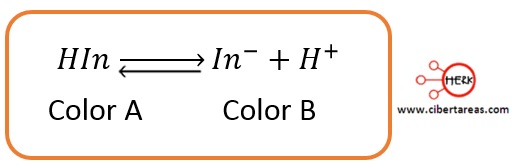
-La expresión para la constante de disociación acida (Ka) será: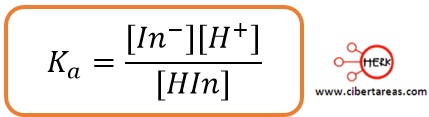
-Se puede escribir de la siguiente manera: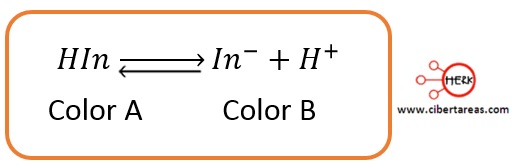
-Al analizar la expresión anterior tenemos que:
-Si el medio es ácido:
-La concentración de iones hidrógeno aumenta, lo que implica que la relación [In–] / [HIn] disminuye y el equilibrio se desplaza hacia la izquierda, aumenta la concentración de HIn y domina su color (el color A)
-Si el medio es básico
-El cociente tendrá que aumentar, el equilibrio se desplaza hacia la derecha, predomina entonces la concentración de In– y domina el color B
Evidentemente, si existe un equilibrio en la concentración de iones hidrógeno y de iones In–, las dos formas coexisten y el color resultante es una mezcla de colores que dependerá de la proporción en la que se hallen las concentraciones
Hay que considerar que existe una gran variedad de indicadores, cada uno de ellos con diferente constante de equilibrio y cuyo uso se recomienda en dependencia del pH de la disolución
En la siguiente tabla se añoran varios de ellos con la coloración que dan y el rango de pH en el que son más útiles: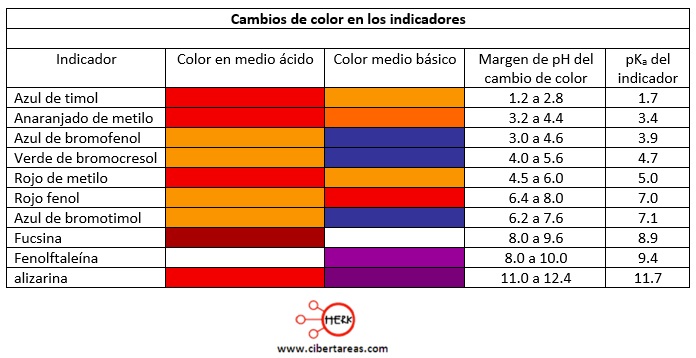
Método potenciométrico
Este método se basa en la medición de la diferencia de potencial que se genera entre los dispositivos del instrumento conocido como pHmetro debido la concentración de iones hidrogeno e hidroxilo presentes en la disolución cuyo pH se mide
El pHmetro es un aparato electrónico, que consta de un electrodo que se introduce en la disolución de pH desconocida
El funcionamiento del pHmetro se basa en que el electrodo contiene una disolución ácida encerrada en una membrana de vidrio especial que permite la migración de los iones H30+
Si la disolución desconocida tiene un pH diferente a la disolución dentro del electrodo, se establece una diferencia de potencial, que se registra en la escala de pH que posee el equipo
El pHmetro permite medir el pH con una precisión de dos cifras decimales
Hay que considerar que para su correcto funcionamiento, el pHmetro debe calibrarse previamente con una disolución patrón de pH perfectamente conocido

