Determinación del reactivo limitante – Química 2
Comúnmente se piensa que en las reacciones se utilizan siempre las cantidades exactas de reactivos, sin embargo en la práctica lo más común es que se emplee un exceso de uno o más reactivos, para lograr que reaccione la mayor cantidad posible de estos
Ejemplo:
Problemática
En la última etapa para la producción del ácido sulfúrico, se necesita la reacción entre el trióxido de azufre (SO3) y el agua (H2O)
Es necesario saber cuál es el reactivo limitante y cuál es el reactivo en exceso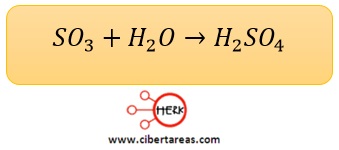
Si se suministran 200 g de SO3 y 200 g de H2O a la reacción:
¿Cuántos gramos de H2SO4 se obtendrán?
¿Cuál es el reactivo limitante y cuál es el reactivo en exceso?
Solución:
-Como la ecuación se encuentra balanceada, e calcula cuantos moles equivalen a los 200 g de SO3 y los 200 g de H2O que entran en reacción
A partir de estos resultados se calcula la cantidad de ácido sulfúrico que se produce, primero con un reactivo y luego con el otro
El reactivo limitante es aquel cuya producción sea menor
El reactivo limitante es:
-Trióxido de azufre (SO3), dado que solo produce 245.09 g de H2SO4
El reactivo en exceso es:
-Agua (H2O)
Conclusión
Para poder determinar cuál es el reactivo limitante se procede de la siguiente manera:


