Grados de acidez o de basicidad de la solución – Química 2
Debemos conocer que la acidez o la alcalinidad de una sustancia están en función de la concentración de iones hidronio que se obtiene al disolverla en agua
En la mayoría de las sustancias naturales comunes, estas concentraciones son muy bajas; por esta razón el poder expresarlas en forma decimal o exponencial resulta complejo, y con frecuencia es fuente de errores
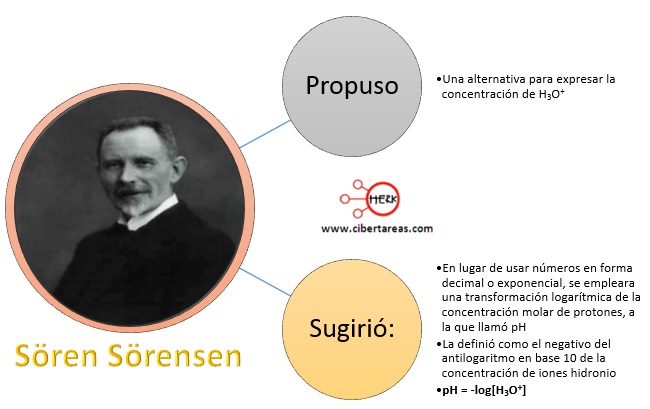
Sören Sörensen, químico danés, propuso una alternativa para expresar la concentración de H3O+, propuso: